1. Introduction
Metastases to the thyroid gland originating from solid tumors are an uncommon phenomenon
that requires different prognosis, diagnostic and therapeutic strategy than primary
thyroid carcinoma [1]. The main sites of origin are renal clear cell carcinoma (approximately 50%), lung
adenocarcinoma, gastrointestinal neoplasms, melanoma, and breast carcinoma [2,3]. This metastatic phenomenon can occur metachronously (60%), synchronously (34%),
or as the first manifestation of the underlying carcinoma (6%) [1,4].
These events represent between 0.13% and 2% of all thyroid malignancies, despite the
thyroid being the endocrine organ with the greatest blood supply, surpassed only by
the pancreas and adrenal glands [5,6]. Hypotheses related to the high blood flow and the high iodine and oxygen content,
which hinder tumor implantation and growth, have been proposed to explain its low
incidence. However, pre-existing thyroid diseases such as thyroiditis, adenomas, multinodular
goiter, or even primary thyroid cancer can create an environment conducive to metastatic
spread [7-9].
Diagnosis presents a significant challenge, especially in the absence of a primary
tumor, thus making immunohistochemistry (IHC) essential [3,4]. This series highlights metastases from renal cell carcinoma and breast cancer,
which, although rare, exemplify clinically and epidemiologically relevant cases due
to their diagnostic complexity and long latency periods. The average interval to the
appearance of thyroid metastases is 8.8 years for renal cell carcinoma and 9 years
for breast carcinoma [2,5,10]. Due to the scarcity of reports, particularly in breast cancer, this publication
seeks to define and distinguish the most used diagnostic studies for these two types
of malignant tumors and compare their therapeutic approach and prognosis within the
fields of oncology and endocrinology.
2. Clinical case 1
We present the case of a 69-year-old man with a history of hypertension and stage
III chronic kidney disease, who in 2017 underwent left radical nephrectomy for clear
cell renal carcinoma (pT1bN1M0, Fuhrman histological grade III). During oncological
follow-up, the patient remained asymptomatic, with a normal physical examination.
A positron emission tomography (PET-CT) scan incidentally revealed a hypometabolic
thyroid nodule (SUVmax [2,6]), prompting the recommendation for monitoring. Subsequently, in 2022, asymptomatic
primary hypothyroidism was diagnosed without palpable findings, and treatment with
levothyroxine 50 mcg/day was initiated. Two years later, a cervical ultrasound revealed
a 3.5 x 2.5 x 3 cm hypoechoic solid nodule with irregular margins, cystic components,
and mixed vascularization, located in the lower pole of the left lobe, classified
as TIRADS 4C (Figure 1), which was palpable. A fine-needle aspiration biopsy (FNAB) of the nodule was performed
and yielded a Bethesda category III.
Figure 1
Cervical ultrasound. Heterogeneous thyroid nodule measuring 3.5 x 2.5 x 3 cm.
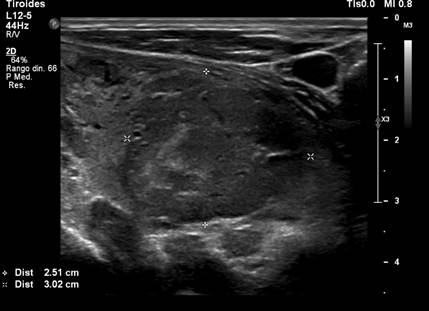
Source: SOLCA Intranet - Guayaquil.
Histopathological study of the total thyroidectomy confirmed metastasis of clear cell
renal cell carcinoma, corroborated by immunohistochemistry (CAM 5.2 and PAX8 positive;
thyroglobulin, CK7, and TTF1 negative). PET-CT staging identified lymphadenopathy
in the left cervical region IV (23 mm, SUV LBM 4) and in the right cervical region
VI (20 mm, SUV LBM 4.8).
Subsequently, the Urological Tumor Committee prescribed systemic treatment with Sunitinib
50 mg, which had to be reduced to 25 mg daily due to toxicity (hand-foot syndrome
and thrombocytopenia). Following surgery, Levothyroxine was adjusted to 88 mcg/day,
achieving a TSH of 0.11 µIU/mL, thyroglobulin of 0.04 ng/mL, and undetectable antithyroglobulin
antibodies.
One year later, a follow-up PET-CT scan showed a decrease in the size and metabolism
of cervical lymph nodes; however, a pulmonary nodule was present in the left lower
lobe (13 mm), along with left hilar lymphadenopathy (12 mm), findings consistent with
systemic tumor progression (Figure 2).
Figure 2
Thoracic PET-CT. Left hilar lymphadenopathy measuring 12 mm, hypermetabolic (SUV LBM
3), suggestive of metastatic origin.
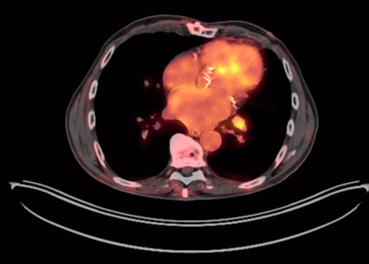
Source: SOLCA Intranet - Guayaquil.
In accordance with the clinical course, second-line treatment with Axitinib 5 mg every
12 hours was initiated. As for the writing of this report, the patient remains in
good general clinical condition (Functional Status Scale grade 1; Karnofsky Performance
Status 90%), and under multidisciplinary follow-up.
3. Clinical case 2
A 49-year-old woman with a history of invasive ductal carcinoma of the right breast
(Grade 2, HER2+++, Ki-67: 60%), with T2N1M0 in 2017, treated with six cycles of docetaxel,
doxorubicin, and cyclophosphamide. In May 2021, following a one-month history of neck
pain, a neck CT scan revealed lymphadenopathy in the posterior triangle (11 mm). A
biopsy was taken, consistent with metastasis of the primary tumor. The patient was
subsequently treated with Pertuzumab, Trastuzumab, and Docetaxel, and later continued
with Letrozole 2.5 mg/day.
A PET-CT scan in December 2023 revealed persistent hypermetabolic lymphadenopathy
in the left lateral cervical region (SUVmax 2.4), as well as increased metabolism
in the right thyroid lobe. A cervical ultrasound in December 2024 identified a 0.69
x 0.72 cm hypoechoic solid thyroid nodule, classified as TIRADS 4A (Figure 3). The fine-needle aspiration biopsy (FNAB) was reported as Bethesda IV, and management
was decided upon with close monitoring.
Figure 3
Cervical ultrasound: Thyroid nodule classified as TIRADS 4A.
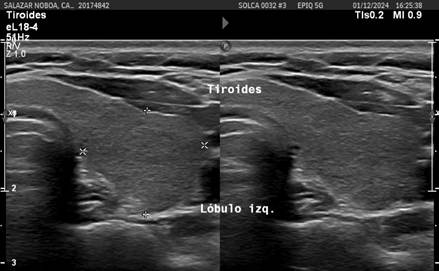
Source: SOLCA Intranet - Guayaquil.
In February 2025, cervical lymph node progression and diffuse hypermetabolic activity
in the thyroid were observed on PET-CT. Consequently, a total thyroidectomy with lymph
node dissection was performed, revealing two distinct neoplasms: thyroid metastasis
from breast carcinoma (IHC: Ki-67, HER2, PR, and GATA3 positive; TTF1 negative) and
a classic papillary thyroid microcarcinoma, follicular variant pT1a pN1a, in the right
lobe (0.2 cm; IHC: TTF1 and PAX8 positive).
For the microcarcinoma, ablative therapy with I-131 (180 mCi) was administered under
a hormonal withdrawal protocol, with a whole-body scan showing thyroid remnants, without
other iodine-sensitive lesions. Concurrently, for metastatic breast cancer, the patient
continues targeted therapy with dual anti-HER2 blockade (intravenous pertuzumab and
subcutaneous trastuzumab) plus oral capecitabine. At the time of data collection,
the patient remains in optimal general condition (ECOG 0) and under close follow-up.
4. Discussion
Thyroid gland metastases are infrequent; renal clear cell carcinoma is the most implicated.
The presence of thyroid cancer stem cells could explain this phenomenon, given their
role in therapeutic resistance and invasive capacity, interacting with the tumor microenvironment
and alterations in the MAPK and PI3K-Akt signaling pathways, which would favor neoplastic
progression and recurrence [8,11]. This mechanism may have contributed to the clinical course of the described cases,
particularly in breast carcinoma, where the coexistence of metastases promotes accelerated
progression [8,12].
Likewise, the latency period between the primary tumor and thyroid metastasis is often
prolonged due to the phenomenon of “metastatic dormancy,” in which tumor cells remain
inactive before reactivating their proliferation [11,12]. In the reported patients, thyroid metastasis was evident 7 and 8 years after the
diagnosis of renal and breast carcinoma, respectively. This is consistent with the
findings of Tjahjono R. et al., whose median was 92 months (7.6 years) [3,5,10]. From a diagnostic standpoint, these metastases pose a challenge, especially when
the primary tumor is unknown or subclinical. Although imaging techniques are useful,
they lack specificity in distinguishing between primary thyroid carcinoma and metastasis
[9,11,13]. In this context, immunohistochemistry (IHC) is essential for establishing a definitive
diagnosis. Specific markers, such as CD10, CA-IX, and PAX8 in renal cell carcinoma
enable determining its origin. This coincides with Stergianos S. et al., who documented
that 36% of metastatic thyroid tumors originated in the kidney (9,10). In the case
of breast carcinoma, the coexistence of lesions compatible with a primary thyroid
tumor (TTF-1 and TG positive) and ductal carcinoma metastases (GATA3 and estrogen
receptor positive) is an exceptional finding in the literature [1,6,14].
Regarding prognosis, the detection of thyroid metastases is usually associated with
low 5-year survival (<50%) [5]. However, surgical resection is associated with a better outcome in cases of oligometastases,
as observed in both patients who underwent total thyroidectomy and lymphadenectomy.
This may be supported by a retrospective study conducted by Tjahjono R. et al. in
Australia, where, although survival was higher in patients undergoing surgery with
systemic treatment (12 patients) compared to those managed only with systemic therapy/radiotherapy
(3 patients) (130 vs. 36 months), it was not statistically significant (p=0.208) due
to the study sample size and mortality resulting from cancer progression [1,5,6]. Furthermore, the use of tyrosine kinase inhibitors, such as Sunitinib and Axitinib
has shown efficacy in tumor reduction. This aligns with the findings of Tjahjono R.
et al., who demonstrated a median survival of 130 months with these drugs [3]. However, these agents are not free of complications observed with Sunitinib treatment
like toxicity, notably thyrotoxicosis, gastrointestinal toxicity, and hand-foot syndrome
[13]. Finally, in breast carcinoma metastases, hormonal blockade becomes relevant given
the expression of receptors, which can modify the dynamics of tumor dissemination
[15].
Current knowledge on thyroid gland metastases is very limited due to their rarity
and the scarcity of multicenter studies. However, future lines of research are proposed,
such as their application to metastasectomy in renal cell carcinoma [3] or the use of thyroid carcinoma stem cells, which interact with the tumor microenvironment,
to select the most appropriate treatment, thus improving treatment outcomes and prognosis
for these patients [8,11].
5. Conclusion
Thyroid metastases from solid tumors present a diagnostic and therapeutic challenge,
as evidenced by the cases described. These cases underscore the importance of long-term
follow-up in patients with a history of cancer due to the possibility of late recurrences
or unusual metastases. Immunohistochemistry (IHC) is established as a fundamental
tool for determining the tumor origin and guiding therapeutic management.
However, this series has significant limitations. By including only two cases, it
is not possible to make clinical generalizations or causal inferences, which reduces
external validity. Similarly, the lack of extensive clinical follow-up prevents the
evaluation of long-term outcomes. Finally, the coexistence of different neoplasms
in the thyroid gland highlights the biological complexity of cancer and reaffirms
the need for a multidisciplinary approach.
1. Introducción
Las metástasis hacia la glándula tiroides, originadas en tumores sólidos, constituyen
un fenómeno infrecuente que condiciona un pronóstico y una estrategia diagnóstica
y terapéutica distinta al carcinoma primario tiroideo [1]. Los principales sitios de origen son el carcinoma de células claras renales (aproximadamente
el 50 %), el adenocarcinoma de pulmón, neoplasias gastrointestinales, melanoma y,
menos frecuente, el carcinoma mamario [2, 3]. Este fenómeno metastásico puede ocurrir
de manera metacrónica (60 %), sincrónica (34 %) o como primera manifestación del carcinoma
subyacente (6 %) [1, 4].
Estos eventos representan entre el 0,13 % y el 2 % de todas las malignidades tiroideas,
a pesar de que la tiroides es un órgano endocrino con mayor irrigación sanguínea,
solo superado por el páncreas y las glándulas suprarrenales [5, 6]. Para explicar su baja incidencia se han planteado hipótesis relacionadas con el
elevado flujo sanguíneo y el alto contenido de yodo y oxígeno que dificultan la implantación
y crecimiento tumoral; no obstante, enfermedades tiroideas previas como tiroiditis,
adenomas, bocio multinodular o incluso cáncer tiroideo primario pueden favorecer un
ambiente propicio para la diseminación metastásica [7-9].
El diagnóstico representa un gran desafío, especialmente en ausencia de tumor primario
identificado, siendo esencial la inmunohistoquímica (IHQ) [3, 4]. En esta serie se destacan metástasis de carcinoma de células renales y de mama
que, aunque raras, ejemplifican casos de relevancia clínica y epidemiológica por su
alta complejidad diagnóstica y largas latencias. El intervalo promedio hasta la aparición
de metástasis tiroideas es de 8,8 años en carcinoma renal y de 9 años en carcinoma
mamario [2, 5, 10].
Debido a la escasez de reportes, en particular en cáncer de mama, esta publicación
tiene como objetivo definir y distinguir los estudios diagnósticos más empleados en
estos dos tipos de tumores malignos para contrastar su proceso terapéutico y pronóstico
en los ámbitos de la oncología y la endocrinología.
2. Caso clínico 1
Se presenta el caso de un hombre de 69 años con antecedentes de hipertensión arterial
y enfermedad renal crónica estadio iii, quien, en 2017, fue sometido a nefrectomía
radical izquierda por carcinoma renal de células claras (pT1bN1M0, grado histológico
Fuhrman iii). Durante el seguimiento oncológico permaneció asintomático, con exploración
física normal, y se le realizó una tomografía computarizada por emisión de positrones
(PET-CT) que evidenció de forma incidental un nódulo tiroideo hipometabólico (SUVmax)
[2, 6], motivo por el cual se indicó vigilancia.
Posteriormente, en 2022, se diagnosticó hipotiroidismo primario asintomático sin hallazgos
palpables y se inició tratamiento con levotiroxina 50 mcg/día. Dos años después, una
ecografía cervical reveló un nódulo sólido hipoecoico de 3,5 x 2,5 x 3 cm, con márgenes
irregulares, componentes quísticos y vascularización mixta, localizado en el polo
inferior del lóbulo izquierdo, clasificado como TIRADS 4C (Figura 1), el cual resultó palpable. Ante ello, se realizó una punción-aspiración con aguja
fina (PAAF) del nódulo con reporte Bethesda iii.
Figura 1
Ecografía cervical. Nódulo tiroideo heterogéneo de 3,5 x 2,5 x 3 cm
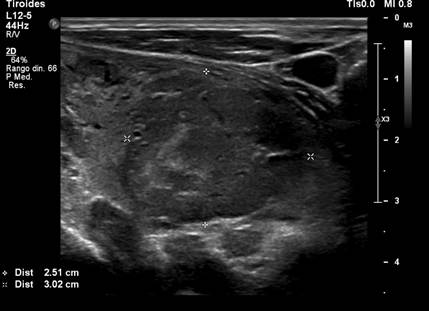
Fuente: Intranet SOLCA, Guayaquil.
El estudio anatomopatológico de la tiroidectomía total confirmó metástasis de carcinoma
renal de células claras, corroborada mediante inmunohistoquímica (CAM 5,2 y PAX8 positivos;
tiroglobulina, CK7 y TTF1 negativos). En la estadificación por PET-CT se identificaron
adenopatías en región cervical iv izquierda (23 mm, SUV LBM 4) y en región cervical
vi derecha (20 mm, SUV LBM 4,8).
Con posterioridad, el Comité de Tumores Urológicos indicó tratamiento sistémico con
sunitinib 50 mg, que debió reducirse a 25 mg diarios por toxicidad (síndrome mano-pie
y trombocitopenia). Tras la cirugía, se ajustó la levotiroxina hasta 88 mcg/día, alcanzando
TSH de 0.11 µUI/mL, tiroglobulina de 0.04 ng/mL y anticuerpos antitiroglobulina indetectables.
Un año después, en un control con PET-CT, se identificó disminución del tamaño y metabolismo
de las adenopatías cervicales; sin embargo, se presentaron un nódulo pulmonar en el
lóbulo inferior izquierdo (13 mm) y adenopatía hiliar izquierda (12 mm), hallazgos
compatibles con progresión tumoral sistémica (Figura 2).
Figura 2
PET-TC torácico. Adenopatía hiliar izquierda de 12 mm hipermetabólica (SUV LBM 3),
sugestiva de origen metastásico
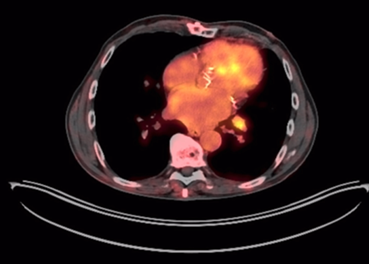
Fuente: Intranet SOLCA, Guayaquil.
En concordancia con la evolución, se decidió iniciar tratamiento de segunda línea
con axitinib 5 mg cada 12 horas. Hasta la redacción del presente informe, el paciente
se mantiene con buen estado clínico general (Escala de estado funcional (ECOG) 1;
índice de Karnofsky 90 %) y bajo seguimiento multidisciplinario.
3. Caso clínico 2
Una mujer de 49 años con antecedente de carcinoma ductal infiltrante de mama derecha
(Grado 2, HER2+++, Ki-67: 60 %), con T2N1M0 en 2017, tratada con seis ciclos de docetaxel,
doxorrubicina y ciclofosfamida. En mayo de 2021, ante dolor cervical de un mes, se
realizó tomografía de cuello que evidenció adenopatía en triángulo posterior (11 mm),
con toma de biopsia compatible con metástasis del tumor primario, motivo por el cual
recibió pertuzumab, trastuzumab y docetaxel, manteniéndose posteriormente con letrozol
2,5 mg/día.
El PET-CT de diciembre de 2023 reveló persistencia de adenopatía hipermetabólica laterocervical
izquierda (SUVmax 2,4) e incremento metabólico en el lóbulo derecho tiroideo. Ulteriormente,
en la ecografía cervical de diciembre 2024, se identificó un nódulo tiroideo sólido
hipoecoico de 0,69 x 0,72 cm, clasificado como TIRADS 4A (Figura 3). La PAAF informó Bethesda iv, frente a lo que se decidió manejo mediante vigilancia
y control evolutivo.
Figura 3
Ecografía cervical: nódulo tiroideo clasificado como TIRADS 4A
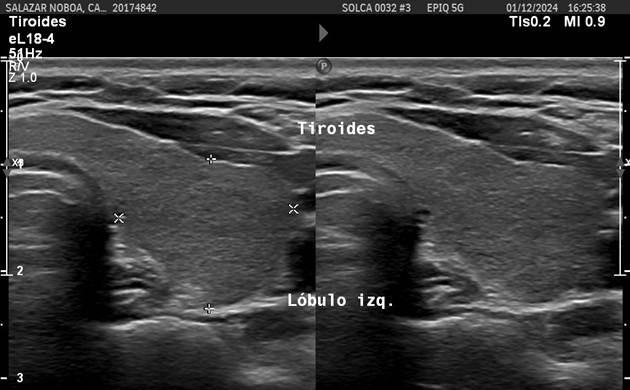
Fuente: Intranet SOLCA, Guayaquil.
En febrero de 2025 se evidenció progresión ganglionar cervical y actividad hipermetabólica
difusa en tiroides en PET-CT. Ante ello, se efectuó tiroidectomía total con vaciamiento
ganglionar y se encontraron dos neoplasias distintas. Por un lado, metástasis tiroidea
de carcinoma mamario (IHQ: Ki-67, HER2, RP y GATA3 positivos; TTF1 negativo), y por
otro, un microcarcinoma papilar clásico de tiroides, variante folicular pT1a pN1a
en lóbulo derecho (0,2 cm; IHQ: TTF1 y PAX8 positivos).
Para el microcarcinoma se administró terapia ablativa con I-131 (180 mCi), bajo protocolo
de suspensión hormonal con rastreo corporal total que mostró remanentes tiroideos,
sin otras lesiones yodocaptantes. Paralelamente, para el cáncer de mama metastásico,
se mantiene en tratamiento dirigido con doble bloqueo anti-HER2 (pertuzumab intravenoso
y trastuzumab subcutáneo, más capecitabina oral).
Al momento de la recolección de datos, la paciente permanece en estado general óptimo
(ECOG 0) y en seguimiento estrecho.
4. Discusión
Las metástasis a glándula tiroides son infrecuentes, siendo el carcinoma de células
claras renales el más comúnmente implicado. La presencia de células madre cancerosas
tiroideas podría explicar este fenómeno, dado su papel en la resistencia terapéutica
y capacidad invasiva, en interacción con el microambiente tumoral y las alteraciones
en las vías de señalización MAPK y PI3K-Akt, lo que favorecería la progresión y recurrencia
neoplásica [8, 11]. Este mecanismo podría haber contribuido a la evolución clínica de los casos descritos,
particularmente en el carcinoma de mama, en el que la coexistencia de metástasis propició
una progresión acelerada [8, 12].
Asimismo, la latencia entre el tumor primario y la metástasis tiroidea suele ser prolongada
debido al fenómeno de dormancia metastásica, en el que células tumorales permanecen inactivas antes de reactivar su proliferación
[11, 12]. En los pacientes reportados, la metástasis tiroidea se evidenció a los 7 y 8 años
del diagnóstico de carcinoma renal y de mama, en concordancia con lo señalado por
Tjahjono et al., cuya mediana fue de 92 meses (7,6 años) [3, 5, 10].
Desde el punto de vista diagnóstico, estas metástasis constituyen un reto, sobre todo
cuando el tumor primario es desconocido o subclínico. Aunque las técnicas de imagen
son útiles, carecen de especificidad para distinguir entre carcinoma primario tiroideo
y metástasis [9, 11, 13]. En este contexto, la IHQ resulta esencial para establecer el diagnóstico definitivo.
Los marcadores específicos como CD10, CA-IX y PAX8 en carcinoma renal, permiten determinar
su origen, lo cual coincide con Stergianos et al., quienes documentaron que el 36 % de los tumores metastásicos en tiroides provenían
del riñón [9, 10]. En el caso de carcinoma mamario, la coexistencia de lesiones compatibles con tumor
tiroideo primario (TTF-1 y TG positivos) y metástasis de cáncer ductal (GATA3 y receptores
de estrógeno positivos) constituye un hallazgo excepcional en la literatura [1, 6, 14].
En cuanto al pronóstico, la detección de metástasis tiroideas suele relacionarse con
baja supervivencia a 5 años (<50 %) [5]. No obstante, la resección quirúrgica se asocia a mejor evolución en casos de oligometástasis,
como se observó en ambos pacientes intervenidos con tiroidectomía total y linfadenectomía.
Ello puede respaldarse en un estudio retrospectivo realizado por Tjahjono et al. en Australia, donde la supervivencia, a pesar de que fue mayor en los pacientes
sometidos a cirugía con tratamiento sistémico (12 pacientes), frente a los manejados
solo con terapia sistémica/radioterapia (tres pacientes) (130 vs. 36 meses), no fue
estadísticamente significativo (p = 0,208) por la muestra del estudio y su mortalidad
debido a la progresión oncológica [1, 5, 6].
Por otra parte, el uso de inhibidores de tirosina quinasa, como sunitinib y axitinib,
ha mostrado eficacia en la reducción tumoral, concordando con lo señalado por Tjahjono
et al., quienes evidenciaron una supervivencia media de 130 meses con estos fármacos [3]. Sin embargo, estos agentes no están exentos de toxicidad, destacando la tirotoxicosis,
la toxicidad gastrointestinal y el síndrome mano-pie, complicaciones observadas en
el tratamiento con sunitinib [13]. Finalmente, en metástasis de carcinoma mamario, el bloqueo hormonal adquiere relevancia
dada la expresividad de receptores, lo que puede modificar la dinámica de diseminación
tumoral [15].
El conocimiento actual sobre las metástasis a glándula tiroides es muy limitado por
su rareza y la escasez de estudios multicéntricos. Pese a esto, se proponen futuras
líneas de investigación como la aplicación sobre la metastasectomía en el carcinoma
de células renales [3] o el uso de las células madre del carcinoma de tiroides, que conllevan a interacciones
con el microambiente tumoral, para una selección del tratamiento más apropiado, mejorando
su resultado y el pronóstico de estos pacientes [8, 11].
5. Conclusión
Las metástasis a la glándula tiroides desde tumores sólidos, aunque poco frecuentes,
constituyen un desafío diagnóstico y terapéutico, tal como evidencian los casos descritos.
Estos subrayan la relevancia del seguimiento prolongado en pacientes con antecedentes
oncológicos, debido a la posibilidad de recurrencias tardías o metástasis inusuales.
La IHQ se establece como herramienta fundamental para precisar el origen tumoral y
orientar la conducta terapéutica.
No obstante, esta serie presenta limitaciones importantes, por ejemplo, al incluir
únicamente dos casos, no es posible realizar generalizaciones clínicas ni inferencias
causales, lo que reduce su validez externa. De igual manera, la ausencia de un seguimiento
clínico extenso impide evaluar desenlaces a largo plazo.
Finalmente, la coexistencia de distintas neoplasias en la glándula tiroides pone de
relieve la complejidad biológica del cáncer y reafirma la necesidad de un abordaje
multidisciplinario.