Diagnostic challenge in gastrointestinal bleeding due to GIST: Case report
Article / Artículo
https://doi.org/10.33821/774
Date received: 06/1/2025
Date accepted: 10/3/2025
Date: 30/4/2025
1. Introduction
Gastrointestinal stromal tumors (GISTs) have a global incidence of 10 to 20 cases
per million people each year [1]. The average age at diagnosis is around 60 years, with no clear difference between
sexes, although some studies suggest a higher prevalence in men. These neoplasms can
affect the entire gastrointestinal tract, and in less than 1% of cases, they can present
as extra-intestinal [2,3].
Extra-intestinal gastrointestinal stromal tumors (EGISTs) are rare, representing less
than 5% of all GISTs, around 80% are located in the omentum or mesentery [4]. Three theories have been proposed for their development: the first suggests they
originate in the gastrointestinal tract, with an exophytic growth followed by the
acquisition of autonomy; the second suggests that EGISTs are peritoneal metastases
of an undetected GIST; and the third proposes a mesothelial origin with characteristics
similar to those of the Cajal cells [5].
Ninety percent of primary GISTs may have mutations in the KIT gene (in 80% of cases),
resulting in a positivity for the monoclonal antibody CD-117 in 94-95% of cases, or
in the PDGFRA gene (in the remaining 10%). The remaining 10% do not have mutations
in either of these genes, so they are classified as wild-type GISTs. The main treatment
is surgical resection, which can be curative in most cases [6].
This article presents a case of a GIST located in the mesentery, a rare site, diagnosed
from an episode of persistent gastrointestinal bleeding.
2. Clinical Case
A 46-year-old female patient with a history of uterine fibroids, unspecified anemia,
radical hysterectomy, and two cesarean deliveries. Her family history includes hypertension
in her mother and siblings, and neurofibromatosis type 1 in her father and one brother.
She was admitted with a condition of several days’ duration, characterized by melena,
without abdominal pain and exacerbation over the last 48 hours, reporting lower gastrointestinal
bleeding of approximately 400 cc. Upon examination, she presents generalized pallor,
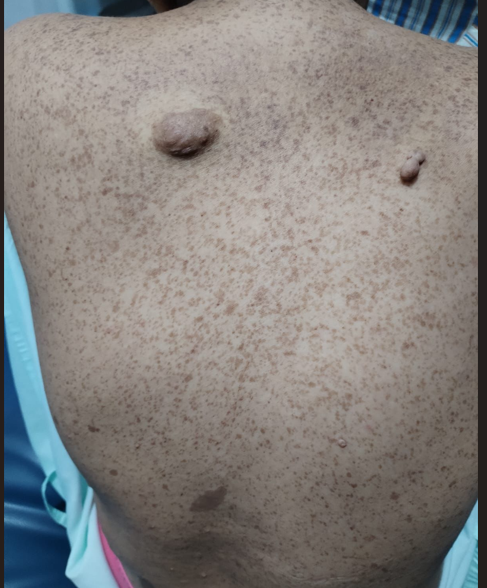
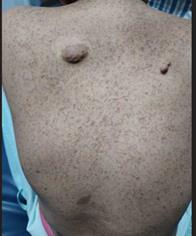
café-au-lait spots on her skin, and nodules on her posterior chest (Image 1). Laboratory studies reveal hemoglobin of 3.3 g/dl, hematocrit of 10%, and platelet
count of 67,000 IU, thus categorizing her as having grade III hypovolemic shock due
to upper gastrointestinal bleeding. A transfusion of packed red blood cells is initiated,
along with treatment with proton pump inhibitors. Due to the severity of her condition,
it was decided to admit her to the intensive care unit for continuous monitoring and
further studies.
Image 1
Hyperpigmented and hypopigmented macules (café-au-lait color), with small tumors compatible
with fibromas in the posterior thoracic region.
The patient is evaluated by the Gastroenterology service, which schedules an upper
gastrointestinal endoscopy that showed normal mucosa without identifying the site
of the bleeding. Subsequently, a colonoscopy is performed, revealing large clots and
blood remnants that hinder the continuation of the study, so it is rescheduled for
48 hours later.
In the following days, the patient does not present new episodes of melena and maintains
a stable hemoglobin level of 7.4 g/dl, without the need for transfusions. In the new
colonoscopy, abundant blood remnants are observed throughout the colon. Due to the
difficulty in locating the source of the bleeding, a capsule endoscopy study is scheduled.
On the fifth day of hospitalization, a slight decrease in hemoglobin levels is recorded
(from 9.9 g/dl to 8.8 g/dl), and the diagnosis of gastrointestinal bleeding of uncertain
origin is maintained. The capsule endoscopy study reveals normal villi in the duodenum,
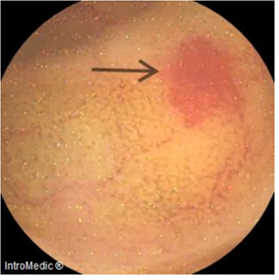
jejunum, and ileum, along with angiectasia in the proximal ileum (Image 2), without evidence of tumor lesions.
Image 2
Capsule endoscopy at the level of the ileum (proximal angiectasia).
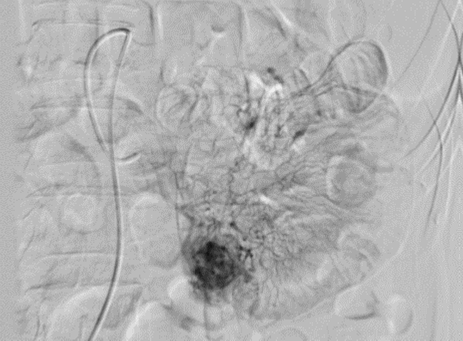
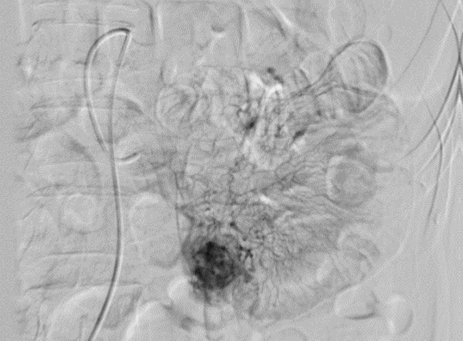
A diagnostic angiography is performed, revealing a hypervascular solid lesion in the
mesenteric branch of the proximal ileum (Image 3), which could correspond to a GIST tumor.
Image 3
Mesenteric angiography, showing an image compatible with a GIST tumor.
In reference to this finding and the family history of neurofibromatosis, imaging
studies of the brain, chest, abdomen, and pelvis are requested, along with a thyroid
ultrasound and tumor markers. Notably, the brain MRI, both simple and contrast-enhanced,
shows enlargement of the optic chiasm and the intracranial segment of both optic nerves
in the suprasellar region, isointense to gray matter on T1 and T2 sequences. After
contrast administration, there is a slight heterogeneous enhancement, a finding suggestive
of an optic pathway glioma (Image 4). Further tumor marker results are collected: carcinoembryonic antigen, alpha-fetoprotein,
CA125, CA19-9, CA15-3, CA72-4, all negative, as well as additional imaging studies
that rule out the presence of neoplasms in extra-intestinal organs.
On the 15th day of hospitalization, due to the persistence of melena episodes, the
General Surgery service decided to perform a diagnostic and therapeutic laparoscopy.
During the surgical intervention, a distended gallbladder with thickened and edematous
walls and internal calculi is observed. Additionally, dense adhesions between the
gallbladder and colon, as well as between the gallbladder and duodenum, are identified.
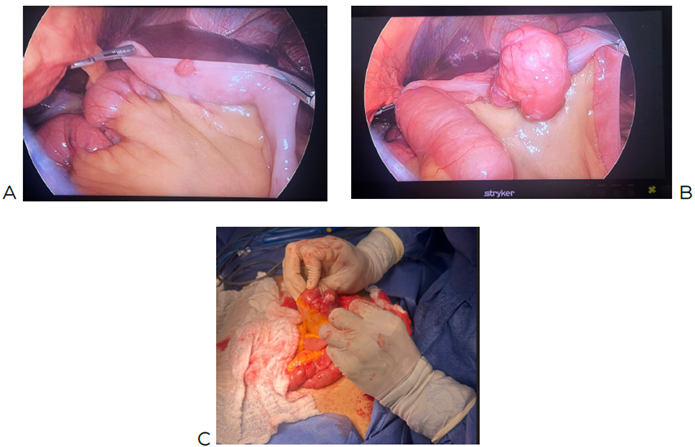
In the proximal jejunum, between 4 and 20 small tumors are found on the antimesenteric
borders, located 30 and 40 cm from the Treitz angle. A rounded and irregular tumor
of 4 cm is also observed on the antimesenteric border of the distal jejunum, 140 cm
from the Treitz angle, vascularized and protruding into the abdominal cavity and the
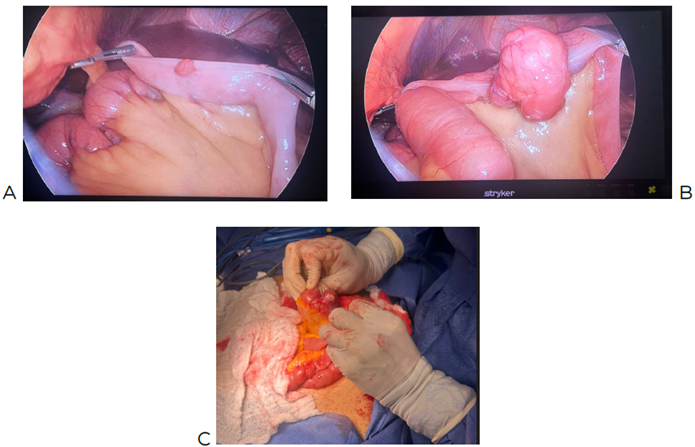
intestinal lumen (Image 5). Surgical resection of the intestinal tumor is performed, along with laterolateral
isoperistaltic anastomosis, and samples are taken for histopathological study.
Image 4
A: Simple brain MRI showing optic glioma and thickening of the optic nerve and optic
chiasm. B: Diffusion MRI confirming the presence of optic glioma.
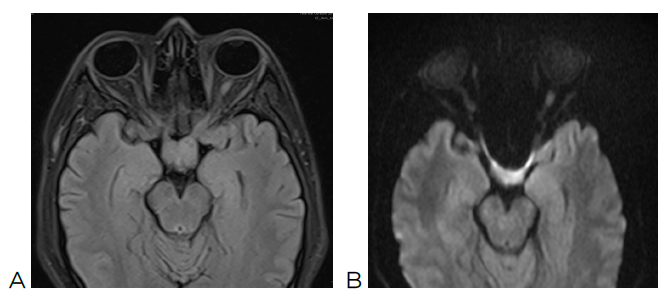
Image 5
A: Image obtained by laparoscopic surgery, showing small tumors on the antimesenteric
border. B: 4 cm tumor located 140 cm from the Treitz angle. C: Larger tumors in the
intestine.
The patient, after the surgical intervention, shows good oral tolerance and no new
evidence of active gastrointestinal bleeding in the subsequent days.
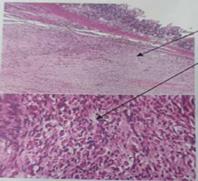
During her recovery in the hospital, the biopsy result of the small intestine segment
is obtained. The findings reveal a 5 cm biphasic mesenchymal neoplasm with slight
atypia and low mitotic activity, consistent with a low-grade GIST. As a result, the
patient was transferred in optimal health conditions to a third-level oncology center
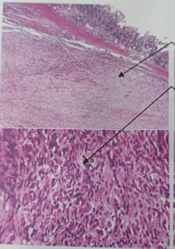
to continue her comprehensive oncological treatment (Image 6).
Image 6
Histopathological finding of intestinal tumor: with H&E staining, a moderately differentiated
neoplasm is observed, composed of fusiform elements with slight atypia. At higher
magnification, elongated nuclei arranged in loose fascicles are seen.
3. Discussion
Gastrointestinal stromal tumor (GIST) is a rare tumor of the small intestine, with
an incidence of 10 to 20 cases per million inhabitants. Its early diagnosis is difficult
due to nonspecific symptoms; gastrointestinal bleeding being the most common manifestation,
which can be accompanied by anemia, melena, or hematemesis. Fifty percent of patients
report bleeding, and 37.5% report pain, while only 5% are asymptomatic. Diagnosis
is made through endoscopy, endoscopic ultrasound, and computed tomography [7,8,9]. In this case, the upper gastrointestinal endoscopy and colonoscopy were normal,
so an abdominal angiography was performed, which located the vascular lesion at the
mesenteric level, with a possible diagnostic of GIST based on imaging. What makes
this case unique is its unusual location that makes it a diagnostic challenge during
the approach.
Patients with neurofibromatosis type 1 have a higher risk of developing GIST, with
a frequency of 5-25%. Gastrointestinal manifestations include submucosal hyperplasia,
stromal tumors, carcinoids, and a greater predisposition to adenocarcinomas. GISTs
in these patients may appear late, even after cutaneous symptoms, and are more common
in women. They are often asymptomatic, especially if they are smaller than 3 cm, but
they can cause gastrointestinal bleeding, anemia, abdominal pain, and intestinal obstruction
[10,11]. It is important to note that the patient did not have an established diagnosis of
neurofibromatosis, but due to her family history, specifically her brother, this condition
should also be considered in her case, as it could be linked to GIST tumors. The main
treatment is surgical, followed by adjuvant therapy with kinase inhibitors to reduce
the growth of microscopic tumors after resection [12]. Imatinib is the drug of choice, showing improved recurrence-free survival. In cases
where resection is not possible, neoadjuvant treatment with Imatinib for 4 to 6 months
before surgery is considered, evaluated by computed tomography or PET scan [13,14]. Other therapeutic options within this family include Sunitinib and Regorafenib,
which have been approved for patients who have previously received Imatinib, thus
providing an additional option for subsequent treatment lines. Currently, the PEAK
clinical trial is underway. This phase III study is evaluating the combination of
Sunitinib with Bezuclastinib (formerly known as CGT-9486) in patients with progressive
GIST after limited response to Imatinib treatment [15].
The prognosis after surgery depends on factors such as the mitotic rate, tumor size,
location, surgical margins, and tumor rupture status. Studies show that most patients
remain disease-free after surgical resection and adjuvant treatment, with success
rates of 82% at 1 year, 89% at 3 years, and 92% at 5 years [16].
4. Conclusions
EGISTs are a rare and difficult-to-diagnose pathology that require a comprehensive
approach managed by a multidisciplinary team. Although mesenteric GIST tumors are
uncommon, imaging studies can be useful for early identification and assessing tumor
resectability. Surgery is a crucial step and can offer a favorable prognosis when
the diagnosis is made early. Neoadjuvant or adjuvant support will depend on the results
of the pathological report. Additionally, it is recommended that patients with neurofibromatosis
be screened for this type of tumor, given the higher likelihood of presenting GIST
in this population.
1. Introducción
Las neoplasias del estroma gastrointestinal (GIST) tienen una incidencia mundial de
14 a 20 casos por millón de personas cada año [1]. La edad promedio de diagnóstico es cercana a los 60 años, sin una clara diferencia
entre sexos, aunque algunos estudios sugieren una mayor prevalencia en mujeres Estas
neoplasias pueden afectar todo el tracto gastrointestinal y, en menos del 1 % de los
casos, pueden presentarse de forma extraintestinal [2,3].
Las neoplasias de estroma extra gastrointestinal (EGIST) son raras, representan menos
del 5 % de todos los GIST, de los cuales alrededor del 80 % se encuentran en el epiplón
o mesenterio [4]. Se han propuesto tres teorías para su desarrollo: la primera sugiere que se originan
en el tracto digestivo, con un crecimiento exofítico y posterior adquisición de autonomía;
la segunda plantea que los EGIST son metástasis peritoneales de un GIST no detectado;
y la tercera postula un origen mesotelial con características similares a las de las
células de Cajal [5].
El 90 % de los GIST primarios pueden presentar mutaciones en el gen KIT (en un 80
% de los casos), lo que resulta en una positividad para el anticuerpo monoclonal CD-117
en el 94-95 % de los casos, o en el gen PDGFRA (en el 10 % restante). Ese 10 % restante
no presenta mutaciones en ninguno de estos genes, por lo que se clasifica como GIST
salvaje. El tratamiento principal es la resección quirúrgica, que puede ser curativa
en la mayoría de los casos [6].
El artículo presenta un caso de GIST, de localización mesentérica infrecuente, diagnosticado
a partir de un episodio de sangrado gastrointestinal persistente.
2. Caso clínico
Paciente femenina de 46 años con antecedentes de miomatosis uterina, anemia no especificada,
histerectomía radical y dos partos por cesárea. En cuanto a sus antecedentes familiares,
se reportó hipertensión arterial en su madre y hermanos, así como neurofibromatosis
tipo 1 en su padre y uno de sus hermanos. Ingresó por un cuadro de varios días de
evolución, caracterizado por melenas, sin dolor abdominal, con exacerbación en las
últimas 48 horas, con sangrado digestivo bajo de aproximadamente 400 ml. En el examen
físico se observó palidez generalizada, manchas color café con leche en la piel y
nódulos cutáneos en la región torácica posterior (Figura 1). Los estudios de laboratorio revelaron hemoglobina de 3,3 g/dl, hematocrito de 10
% y plaquetas de 67,000 uL, lo que categoriza el cuadro como choque hipovolémico grado
III por hemorragia digestiva alta. Se inicia transfusión de concentrados globulares
y tratamiento con inhibidores de la bomba de protones. Debido a la gravedad de su
estado, se decide su ingreso al área de cuidados intensivos para monitoreo continuo
y estudios adicionales.
Figura 1
Máculas hiper e hipopigmentadas (color café con leche), con pequeñas tumoraciones
compatibles con fibromas en la región torácica posterior.
La paciente fue evaluada por el servicio de Gastroenterología; este programó una endoscopia
digestiva alta que mostró mucosas normales sin evidenciar el sitio del sangrado. Posteriormente,
se realizó una colonoscopia, que evidenció grandes coágulos y restos hemáticos que
dificultaron la continuación del estudio, por lo que se reprogramó para 48 horas después.
En los días siguientes, la paciente no presentó nuevos episodios de deposiciones melénicas
y mantuvo una hemoglobina estable de 7,4 g/dl, sin necesidad de transfusiones. En
la nueva colonoscopia, se observaron abundantes restos hemáticos a lo largo del colon.
Debido a la dificultad en la localización del origen del sangrado, se programó un
estudio con cápsula endoscópica.
Al quinto día de hospitalización, se registró un leve descenso en los niveles de hemoglobina
(de 9,9 g/ dl a 8,8 g/dl) y continuó el diagnóstico de hemorragia digestiva de origen
incierto. El estudio con cápsula endoscópica reveló vellosidades normales en el duodeno,
el yeyuno y el íleon, además de angiectasia en el íleon proximal (Figura 2), sin evidencia de lesiones tumorales.
Se realizó angiografía diagnóstica y se evidenció en el ramo mesentérico del Íleon
proximal una lesión de aspecto sólido hipervascular (Figura 3) que podría corresponder a un tumor GIST.
Figura 2
Cápsula endoscópica en el íleon (angiectasia proximal).
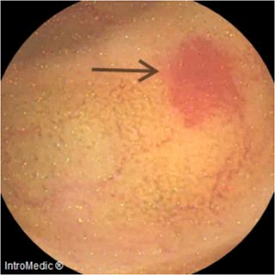
Figura 3
Angiografía mesentérica, se evidencia imagen compatible con tumor GIST.
Con base en este hallazgo y el antecedente familiar de neurofibromatosis, se solicitaron
estudios de imagen correspondientes a cráneo, tórax, abdomen y pelvis, así como ecografía
de tiroides y determinación de marcadores tumorales. Llama la atención la resonancia
magnética de cráneo simple y contrastada, pues reveló en la región supraselar engrosamiento
del quiasma óptico y del segmento intracraneal de ambos nervios ópticos, isointensos
a la sustancia gris en secuencias T1 y T2. Tras la administración de medio de contraste,
se observó un realce de aspecto heterogéneo leve. Hallazgo sugestivo de glioma de
la vía óptica (Figura 4).
Los resultados de los marcadores tumorales -antígeno carcinoembrionario, alfafetoproteína,
CA 125, CA 19-9, CA 15-3 y CA 72-4- fueron negativos. Los estudios adicionales de
imágenes descartaron la presencia de neoplasias en órganos extraintestinales.
Al día 15 de hospitalización, ante la persistencia de episodios de melena, el servicio
de Cirugía General decidió realizar una laparoscopía diagnóstica y terapéutica. Durante
la intervención quirúrgica, se observó una vesícula biliar distendida, con paredes
engrosadas y edematosas, y cálculos en su interior. Además, se identificaron adherencias
densas colecistocolónicas y colecistoduodenales.
En el yeyuno proximal, se encontraron entre 4 y 20 pequeñas tumoraciones en los bordes
antimesentéricos, localizadas a 30 y 40 cm del ángulo de Treitz. También se observó
un tumor redondeado e irregular de 4 cm en el borde antimesentérico del yeyuno distal,
a 140 cm del ángulo de Treitz, vascularizado y protruyendo hacia la cavidad abdominal
y la luz intestinal (Figura 5). Se procedió a la resección quirúrgica del tumor intestinal, seguida de una anastomosis
laterolateral isoperostáltica. Se tomaron muestras para estudio histopatológico.
Figura 4
A: RMN cerebro simple en el que se observa glioma óptico y engrosamiento de nervio
y quiasma ópticos. B: RMN de difusión en la que se confirma la presencia de glioma
óptico.
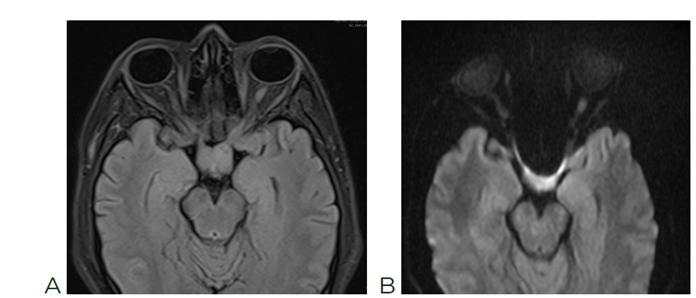
Figura 5
A: imagen obtenida por cirugía laparoscópica, pequeñas tumoraciones en borde antimesentérico.
B: tumor de 4 cm a 140 cm del ángulo de Treitz. C: mayor tumoración en el intestino.
La paciente evolucionó favorablemente luego de la intervención quirúrgica, con buena
tolerancia oral y sin nueva evidencia de sangrado digestivo activo en los días subsecuentes.
Durante la recuperación en hospitalización, se obtuvo el resultado de la biopsia del
segmento del intestino delgado. Dichos hallazgos revelan una neoplasia mesenquimal
bifásica de 5 cm, con discreta atipia y escasa actividad mitótica, consistente con
un GIST de bajo grado, por lo que la paciente fue derivada en condiciones óptimas
de salud a un centro oncológico de tercer nivel para continuar con su tratamiento
oncológico integral (Figura 6).
Figura 6
Hallazgo histopatológico de tumoración intestinal: con tinción de HE se observa neoplasia
moderadamente diferenciada, constituida por elementos fusiformes con escasa atipia.
A mayor aumento, se observan los núcleos alargados dispuestos en fascículos laxos.
3. Discusión
El GIST es un tumor raro del intestino delgado, con una incidencia de 14 a 20 casos
por millón de habitantes. Su diagnóstico precoz es difícil debido a los síntomas inespecíficos;
el sangrado gastrointestinal es la manifestación más común, que puede ir acompañado
de anemia, melena o hematemesis. El 50 % de los pacientes reportan sangrados y el
37,5 % dolor, mientras que solo el 5 % es asintomático. El diagnóstico se realiza
mediante endoscopia, ecografía endoscópica y tomografía computarizada [7-9]. En este caso, la endoscopia y colonoscopia digestiva fueron normales, por lo que
se realizó una angiotomografía abdominal que localizó la lesión vascular en el mesenterio,
con posibilidad diagnóstica de tumor GIST por imagenología. Lo particular de este
caso es la localización inusual de la neoplasia, que representó un reto diagnóstico
a la hora del abordaje clínico y terapéutico.
Los pacientes con neurofibromatosis tipo 1 tienen un mayor riesgo de desarrollar GIST,
con una frecuencia del 5-25 %. Las manifestaciones gastrointestinales incluyen hiperplasia
de la submucosa, tumores estromales, carcinoides y mayor predisposición a adenocarcinomas.
Los GIST en estos pacientes pueden aparecer tardíamente, incluso después de los síntomas
cutáneos, y son más comunes en mujeres. A menudo son asintomáticos, especialmente
si son menores de 3 cm, pero pueden causar hemorragia digestiva, síndrome anémico,
dolor abdominal y obstrucción intestinal [10,11]. Cabe recalcar que la pzaciente no tenía diagnóstico establecido de neurofibromatosis;
sin embargo, por el antecedente familiar de su hermano, debe considerarse también
en ella esta patología, que podría estar ligada a tumores GIST. El tratamiento principal
es quirúrgico, seguido de terapia adyuvante con fármacos inhibidores de la cinasa
para reducir el crecimiento de tumores microscópicos tras la resección [12]. El imatinib es el fármaco de elección, pues ha demostrado una mejora en la supervivencia
sin recidiva.
En casos en los que la resección quirúrgica no es viable, se considera el tratamiento
neoadyuvante con imatinib durante cuatro a seis meses antes de la cirugía, con evaluación
mediante tomografía computarizada o tomografía por emisión de positrones (PET scan)
[13,14]. Entre las demás opciones terapéuticas que corresponden a esta familia, se tiene
el sunitinib y el regorafenib, los cuales han sido aprobados para pacientes que han
recibido previamente imatinib; estos proporcionan una opción adicional en líneas de
tratamiento posteriores. En la actualidad, se está llevando a cabo el ensayo clínico
PEAK, un estudio de fase III que evalúa la combinación de sunitinib y bezuclastinib
(anteriormente conocido como CGT-9486) en pacientes con GIST progresivo tras poca
respuesta al tratamiento con imatinib [15].
El pronóstico después de la cirugía depende de factores como la tasa mitótica, el
tamaño del tumor, la localización, los márgenes quirúrgicos y el estado de ruptura
del tumor. Los estudios muestran que la mayoría de los pacientes permanecen libres
de la enfermedad después de la resección quirúrgica y el tratamiento adyuvante, con
tasas de éxito del 82 % a un año, 89 % a los tres años y 92 % a los cinco años [16].
4. Conclusiones
Los EGIST son una patología rara y difícil de diagnosticar, por lo que requieren un
enfoque integral a cargo de un equipo multidisciplinario. Aunque los tumores GIST
mesentéricos son infrecuentes, los estudios de imagen pueden ser útiles para identificarlos
de manera temprana y evaluar la resecabilidad del tumor. La cirugía es un paso crucial
y puede ofrecer un pronóstico favorable cuando el diagnóstico se realiza de forma
temprana. El apoyo neoadyuvante o adyuvante dependerá de los resultados del informe
patológico. Además, se recomienda que los pacientes con neurofibromatosis sean tamizados
para detectar este tipo de tumores, debido a la mayor probabilidad de presentar GIST
en esta población.