Primary breast follicular lymphoma: Case report
Article / Artículo
https://doi.org/10.33821/766
Date received: 05/1/2025
Date accepted: 05/3/2025
Date: 30/4/2025
1. Introduction
Primary breast lymphoma (PML) is a rare neoplasm of the lymphoid tissue of the breast
[1-2] that occurs almost exclusively in women, with a median age of 60-65 years [3-4]. It is defined as a malignant neoplasm occurring primarily in the breast in the absence
of previously identified sites of lymphoma.[5] This pathology is identified by the presence of neoplastic B or T cells, which classifies
it as non-Hodgkin’s lymphoma (NHL) [6] according to the World Health Organization (WHO) diagnostic criteria. There are several
types of NHL: the follicular lymphoma (FL) subtype accounts for 22% of cases [7]. Primary follicular breast lymphoma (PFBL) is a rare disease without extramammary
involvement; its pathogenesis is not yet understood. In general, primary breast lymphoma
presents clinically as a painless palpable mass and is nonspecific on imaging. It
may have a differential diagnosis with breast carcinoma, and a definitive diagnosis
should be made by tumor biopsy [1,6,8]. The aim of this article is to report a rare case of primary follicular breast lymphoma
in a 63-year-old woman, focusing on the diagnostic challenges and the clinical, pathologic,
and imaging features of this unusual presentation. Our goal is to highlight the importance
of integrating radiologic, histopathologic, and immunohistochemical findings in the
accurate diagnosis and management of breast lymphoma. In addition, we emphasize the
role of a multidisciplinary approach in obtaining favorable outcomes. The report was
written in accordance with CARE guidelines to ensure a comprehensive presentation
of cases.
2. Case report
A 63-year-old patient with no pathologic or family history of cancer presented to
a mastologist fourteen months ago for the presence of a nodule in her breast. An ultrasound
was requested and revealed an irregular solid nodule (BIRADS IV/B) in the left breast,
and she was referred for core needle biopsy. This biopsy revealed follicular lymphoid
hyperplasia, consistent with a probable intramammary tumor. The lesion was not consistent
with radiologic imaging and, therefore, was reclassified as BIRADS IV/C.
Three months after diagnosis, the patient underwent surgical resection with intraoperative
frozen pathology. A left breast quadrantectomy and excision of the sentinel node with
intraoperative margin extension was performed with a frozen section diagnosis of undifferentiated
malignant small cell neoplasm, and the material was sent for anatomic pathology and
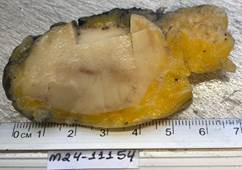
immunohistochemistry. Macroscopic examination revealed a firm, elastic, whitish nodular
tumor measuring 5.2x3x3 cm along the superior and anterior margins (Figure 1). In addition, a 1.2 cm left axillary sentinel lymph node, and the surgical margins
of the breast tissue were examined.
Figure 1
Macroscopic examination revealed a firm elastic whitish nodular tumor measuring 5.2x3x3cm
along the upper and anterior margins.
Microscopic examination of the nodule revealed an undifferentiated small round cell
neoplasm compatible with a follicular lymphoproliferative process (Figure 2), as well as adjacent mammary parenchyma with discrete ductal ectasia. Immunohistochemistry
was requested for definitive diagnosis. Microscopy of the lymph node showed no evidence
of neoplastic involvement. Surgical margins were free of neoplastic involvement.
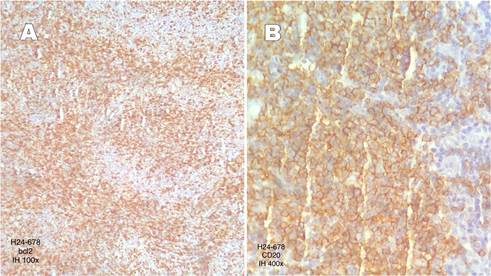
Immunohistochemistry (Figure 3) was positive for CD3, CD20, CD5, CD10, BCL2, BCL6, and PAX5 in the perifollicular
region. The CICLINAD1 marker was negative. The final diagnosis was primary follicular
breast lymphoma grade 1/2. The patient was referred to by a hematologist who ordered
a positron emission tomography scan (PET-Scan) for tumor control. The scan results
were negative for evidence of abnormal metabolic activity in the examined body areas.
As a result, ambulatory monitoring was without indicated the need for chemotherapy
or radiotherapy.
Figure 2A
Histopathology showing a follicular lymphoproliferative process consistent with follicular
lymphoma (HE:100x). Figure 2B. Microscopic examination showing an undifferentiated small round cell neoplasm with
a follicular lymphoproliferative process and adjacent breast parenchyma with discrete
ductal ectasia (HE:40x).
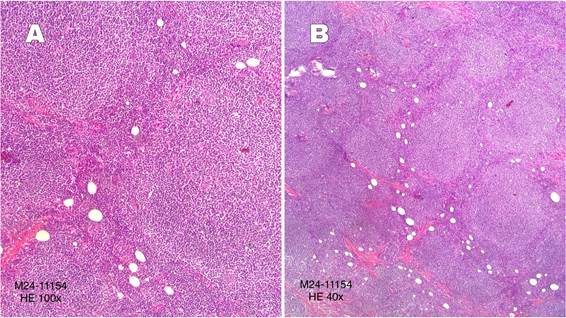
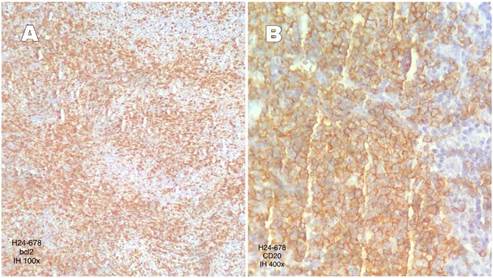
Figure 3A
Immunohistochemical image showing positive perifollicular Bcl-2 staining in the tumor
(HE:100x). Figure 3B. Immunohistochemical image showing positive perifollicular CD20 staining in the tumor
(HE:100x).
3. Discussion
Primary lymphoma accounts for less than 1-2% of all non-Hodgkin lymphomas and less
than 0.5% of all malignant breast neoplasms [4-9]. Diffuse large B-cell lymphoma is the most common subtype of primary breast lymphoma,
accounting for 40% to 70% of cases. Other less common subtypes include marginal zone
lymphoma, follicular lymphoma, and mucosa-associated lymphoid tissue (MALT) [10]. PBL is characterized as a potentially curable neoplasm with clinical features and
prognostic factors that are not yet well established. Its pathophysiology is still
unknown, but it is thought to be derived from MALT, lymphoid tissue adjacent to mammary
ducts and lobules or even from intramammary lymph nodes. Its clinical and imaging
presentation is not different from that of breast carcinoma, the most common manifestations
being a palpable, painless nodule, and about 12% of cases are incidental findings
on mammography, as the patient is asymptomatic [3]. The low incidence of primary follicular lymphoma in the breast makes it difficult
to generalize therapeutic approaches and prognoses [1,5]. Although a suspicious lesion was observed on ultrasound, core needle biopsy yielded
inconclusive results, which raised doubts and made a definitive diagnosis difficult.
Criteria defined for the diagnosis of PBL [11] are breast as the site of presentation, breast tissue in association with lymphomatous
infiltration, absence of disseminated disease beyond the ipsilateral axillary lymph
nodes, and no previous diagnosis of lymphoma [3,9]. It is worth noting that these criteria exclude secondary breast lymphomas, i.e.,
those arising at a primary site but disseminating and manifesting in the breast [6]. Diagnostic criteria include the presence of breast tissue and lymphomatous infiltrate
in an adequate specimen and the absence of previous disseminated or extramammary lymphoma,
except in ipsilateral axillary lymph nodes [3]. PFBL is thought to originate from follicular B cells in mammary lymphoid tissue
and is histologically distinct from other variants of PBL due to the presence of small
follicles with small atypical centrocytes with cleaved nuclei. The clinical behavior
of primary follicular lymphoma in the breast is heterogeneous, with unpredictable
recurrence rates [2,4].
On mammography, most lesions are hyperdense oval masses, whereas on ultrasound they
are single oval, circumscribed, microlobulated lesions. They are usually hypoechoic
and calcifications or spiculated margins are uncommon [3,12]. The diagnosis of PFBL is usually made by excisional biopsy or wide excision of the
tumor, confirmed by anatomopathological examination [7]. Characteristically, tumor cells express CD19, CD20, CD10 and BCL64 proteins, as
well as the anti-apoptotic protein BCL25. In the case presented by Urooj et al., 2022,
the immunophenotypic analysis was positive for CD20, CD10, BCL2 and BCL6 markers,
resulting in a histological diagnosis of follicular Non-Hodgkin’s Lymphoma and corroborating
the results found in the examinations of this article [13-14].
PFBL has an excellent prognosis after treatment, with an overall response rate of
97% according to one study [6]. There is still no consensus on the best therapeutic approach, which may include
surgery, radiotherapy, chemotherapy, or immunotherapy [3]. Mastectomy has been a common component of therapy for primary breast lymphoma, but
some studies show that there is no benefit to this type of approach, with radical
surgery being an unnecessary option. In this case, surgery would be limited to a biopsy
to establish the correct histologic diagnosis, leaving treatment with curative intent
to radiotherapy and chemotherapy [2,5]. In the reported case, breast quadrantectomy at the site of the nodule was curative
for the neoplasm, and no other affected areas were found by PET-Scan, thus excluding
the indication for adjuvant radiotherapy or chemotherapy. One study revealed a reduced
risk of recurrence in treatment with radiotherapy alone or in combination with surgery,
and this has since been supported by others [6]. Therapeutic decisions, such as the choice between radiotherapy and chemotherapy,
still lack consensus due to the rarity of the condition [6,9].
As for chemotherapy, the regimen of Cyclophosphamide, Doxorubicin, Vincristine and
Prednisone (CHOP) is the most widely accepted. However, there is still controversy
about the selection criteria for combination therapy. Five-year survival varies from
89% in stage I cases to 50% in stage II and, in some reports, age is considered an
independent factor for long-term survival [3]. One study showed successful treatment of high-grade PFBL with radiotherapy in combination
with Rituximab-Cyclophosphamide, Hydroxyunorubicin, Oncovin, and Prednisone (R-CHOP)
[7].
Primary breast lymphoma behaves differently from nodal lymphomas and its early diagnosis
is of great relevance. Prognosis depends mainly on the type, grade, and stage of the
lymphoma. Its clinical presentation and nonspecific imaging features require a review
of the clinical history, a multimodality imaging approach and histopathology for diagnosis
and treatment [6,12,13,15]. As noted by Picasso et al., the lack of specific data on this subtype contributes
to uncertainties regarding survival [15]. Therefore, primary and secondary lymphomas, although rare, should be considered
in the differential diagnosis of breast neoplasms [1,6,7].
4. Conclusion
Although primary follicular breast lymphoma is a rare entity, it should be considered
in the differential diagnosis of breast neoplasms, especially in older women. Diagnosis
by imaging tests is challenging, which makes anatomopathological and immunohistochemical
analysis essential for a definitive diagnosis.
1. Introducción
El linfoma primario de mama (LPM) es una neoplasia rara del tejido linfoide de la
mama [1,2] que ocurre casi exclusivamente en mujeres, con una edad media de 60-65 años [3-4]. Se define como una neoplasia maligna que ocurre principalmente en la mama, sin evidencia
de compromiso en otros sitios al momento del diagnóstico [5]. Esta patología se identifica por la presencia de células neoplásicas B o T, por
lo que se clasifica, según los criterios diagnósticos de la Organización Mundial de
la Salud (OMS), como linfoma no Hodgkin (LNH) [6].
Entre los distintos subtipos de LNH, el linfoma folicular (LF) es el que representa
el 22 % de los casos [7]. El linfoma folicular primario de mama (LFPM) es una enfermedad rara sin afectación
extramamaria, cuya patogénesis aún no se comprende. En general, el LPM se presenta
clínicamente como una masa palpable indolora y es no específica en las imágenes. Puede
tener un diagnóstico diferencial con carcinoma de mama, y debe hacerse un diagnóstico
definitivo mediante biopsia tumoral [1,6,8].
El objetivo de este artículo fue informar un caso raro de LFPM en una mujer de 63
años, a partir de los desafíos diagnósticos y las características clínicas, patológicas
e imagenológicas de esta presentación atípica. Además,objetivo e se resalta la importancia
de integrar los hallazgos radiológicos, histopatológicos e inmunohistoquímicos en
el diagnóstico y manejo preciso del LPM, y se enfatiza el papel de un enfoque multidisciplinario
en la obtención de resultados favorables. Este informe fue redactado según las directrices
CARE (Case Report Guidelines) para asegurar una presentación exhaustiva de los casos.
2. Reporte de caso
Paciente de 63 años sin antecedentes patológicos ni familiares de cáncer, acude al
servicio de mastología por presentar un cuadro clínico de catorce meses de evolución
caracterizado por la presencia de un nódulo en la mama izquierda. Se solicito una
ecografía de mama que reveló un nódulo sólido irregular, clasificado como BIRADS IV/B,
y fue remitida para una biopsia con aguja gruesa. Esta biopsia reveló hiperplasia
linfoide folicular, consistente con un probable tumor intramamario. La lesión no era
consistente con la imagen radiológica y, por lo tanto, fue reclasificada como BIRADS
IV/C.
Tres meses después del diagnóstico, la paciente fue sometida a una resección quirúrgica
con análisis de congelación intraoperatoria. Se realizó una cuadrantectomía de la
mama izquierda y una escisión del ganglio centinela con extensión de márgenes intraoperatoria;
el diagnóstico fue de neoplasia maligna indiferenciada de células pequeñas. El material
fue enviado a anatomía patológica y para estudios de inmunohistoquímica. El examen
macroscópico reveló un tumor nodular firme, elástico y blanquecino que medía 5,2x3x3
cm a lo largo de los márgenes superior y anterior (Figura 1). Además, se examinó un ganglio linfático centinela axilar izquierdo de 1,2 cm y
los márgenes quirúrgicos del tejido mamario.
Figura 1
El examen macroscópico reveló un tumor nodular firme, elástico y blanquecino que medía
5,2x3x3 cm, localizado en los márgenes superior y anterior.
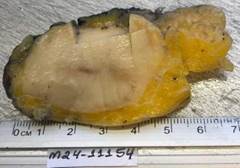
El examen microscópico del nódulo reveló un neoplasma de células redondas pequeñas
no diferenciadas compatible con un proceso linfoproliferativo folicular (Figura 2), así como parénquima mamario adyacente con ectasia ductal discreta. Se solicitó
inmunohistoquímica para el diagnóstico definitivo. La microscopía del ganglio linfático
no mostró evidencia de involucramiento neoplásico. Los márgenes quirúrgicos estaban
libres de afectación neoplásica.
La inmunohistoquímica (Figura 3) fue positiva para CD3, CD20, CD5, CD10, BCL2, BCL6 y PAX5 en la región perifolicular.
El marcador CICLINAD1 fue negativo. El diagnóstico final fue LFPM grado 1/2. La paciente
fue referida a un hematólogo que ordenó una tomografía por emisión de positrones (PET-Scan)
para controlar el tumor. Los resultados de la exploración fueron negativos para evidencias
de actividad metabólica anormal en las áreas del cuerpo examinadas. Como resultado,
se indicó seguimiento ambulatorio sin necesidad de quimioterapia o radioterapia.
Figura 2A
Histopatología que muestra un proceso linfoproliferativo folicular compatible con
linfoma folicular (HE:100x). Figura 2B. Examen microscópico que evidencia una neoplasia de células pequeñas redondas indiferenciadas
con un proceso linfoproliferativo folicular y parénquima mamario adyacente con ectasia
ductal discreta (HE:40x).
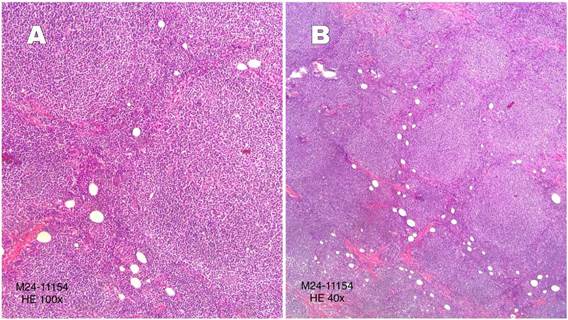
Figura 3A
Imagen de inmunohistoquímica que muestra tinción perifolicular positiva para Bcl-2
en el tumor (HE:100x). Figura 3B. Imagen de inmunohistoquímica que muestra tinción perifolicular positiva para CD20
en el tumor (HE:100x).
3. Discusión
El LPM representa menos del 1-2 % de todos los LNH y menos del 0,5 % de todas las
neoplasias malignas de mama [4-9]. El linfoma difuso de células B grandes es el subtipo más común de LPM, este representa
entre el 40 y el 70 % de los casos. Otros subtipos menos comunes incluyen el linfoma
de zona marginal, el LF y el tejido linfoide asociado a mucosas (MALT) [10]. El LPM se caracteriza como una neoplasia potencialmente curable con características
clínicas y factores pronósticos que aún no están bien establecidos. Su fisiopatología
aún se desconoce, pero se cree que se deriva del MALT, tejido linfoide adyacente a
los conductos y lóbulos mamarios o incluso de los ganglios linfáticos intramamarios.
Su presentación clínica e imagenológica no es diferente de la del carcinoma de mama.
Las manifestaciones más comunes son un nódulo palpable e indoloro, y alrededor del
12 % de los casos son hallazgos incidentales en la mamografía, pues la paciente es
asintomática [3]. La baja incidencia de LFPM dificulta la generalización de los enfoques terapéuticos
y los pronósticos [1,5]. Aunque se observó una lesión sospechosa en la ecografía, el diagnóstico de la biopsia
por punción central arrojó resultados inconclusos, lo que generó dudas y dificultó
un diagnóstico definitivo.
Se han definido los siguientes criterios para el diagnóstico de LPM [11]: la mama como el sitio de presentación; tejido mamario en relación con la infiltración
linfomatosa; ausencia de enfermedad diseminada más allá de los ganglios linfáticos
axilares ipsilaterales y ningún diagnóstico previo de linfoma [3,9]. Vale la pena señalar que estos criterios excluyen los linfomas secundarios de mama,
es decir, aquellos que surgen en un sitio primario, pero se diseminan y se manifiestan
en la mama [6]. Los criterios diagnósticos incluyen la presencia de tejido mamario e infiltrado
linfomatoso en una muestra adecuada y la ausencia de linfoma diseminado previo o extramamario,
excepto en los ganglios linfáticos axilares ipsilaterales [3]. Se cree que el LFPM se origina a partir de células B foliculares en el tejido linfoide
mamario y es histológicamente distinto de otras variantes de LPM debido a la presencia
de pequeños folículos con pequeños centrocitos atípicos con núcleos hendidos. El comportamiento
clínico del LFPM es heterogéneo, con tasas de recurrencia impredecibles [2,4].
En la mamografía, la mayoría de las lesiones son masas ovaladas hiperdensas, mientras
que en la ecografía son lesiones ovaladas únicas, circunscritas y microlobuladas.
Suelen ser hipoecoicas y las calcificaciones o los márgenes espiculados no son comunes
[3,12]. El diagnóstico de LFPM generalmente se realiza mediante biopsia escisional o escisión
amplia del tumor, confirmada por examen anatomopatológico [7]. Se caracteriza por las células tumorales que expresan las proteínas CD19, CD20,
CD10 y BCL64, así como la proteína antiapoptótica BCL25. En el caso presentado por
Urooj et al. [7], el análisis inmunofenotípico fue positivo para los marcadores CD20, CD10, BCL2 y
BCL6, lo que resultó en un diagnóstico histológico de linfoma folicular no Hodgkin
(LFNH) y corrobora los resultados encontrados en los exámenes de este artículo [13-14].
El LFPM tiene un excelente pronóstico después del tratamiento, con una tasa de respuesta
general del 97 % según un estudio [6]. Todavía no hay consenso sobre el mejor enfoque terapéutico, que puede incluir cirugía,
radioterapia, quimioterapia o inmunoterapia [3]. La mastectomía ha sido un componente común de la terapia para el LPM, pero algunos
estudios muestran que no hay beneficio en este tipo de enfoque, por lo que la cirugía
radical es una opción innecesaria. En este caso, la cirugía se limitaría a una biopsia
para establecer el diagnóstico histológico correcto, y como tratamiento, con intención
curativa, la radioterapia y la quimioterapia [2,5]. En el caso reportado, la cuadrantectomía mamaria en el sitio del nódulo fue curativa
para la neoplasia, y no se encontraron otras áreas afectadas en el Pet-Scan, excepto
la indicación para radioterapia o quimioterapia adyuvante. Un estudio reveló un riesgo
reducido de recurrencia en el tratamiento con radioterapia sola o en combinación con
cirugía, y esto ha sido respaldado desde entonces por otros casos [6]. Las decisiones terapéuticas, como la elección entre radioterapia y quimioterapia,
aún carecen de consenso debido a la rareza de la condición [6,9].
En cuanto a la quimioterapia, el régimen de ciclofosfamida, doxorrubicina, vincristina
y prednisona (CHOP) es el más aceptado. Sin embargo, todavía hay controversia sobre
los criterios de selección para la terapia combinada. La supervivencia a cinco años
varía del 89 % en casos de etapa I al 50 % en etapa II y, en algunos informes, la
edad se considera un factor independiente para la supervivencia a largo plazo [3]. Un estudio mostró un tratamiento exitoso de LFPM de alto grado con radioterapia
en combinación con rituximab-ciclofosfamida, hidroxido-unorubicina, oncovina y prednisona
(R-CHOP) [7].
El LPM se comporta de manera diferente a los linfomas nodales y su diagnóstico temprano
es de gran relevancia. El pronóstico depende principalmente del tipo, grado y estadio
del linfoma, y su presentación clínica y características de imagen no específicas
requieren una revisión de la historia clínica, un enfoque de imagen multimodal y la
histopatología para el diagnóstico y el tratamiento [6,12,13,15]. Como señalaron Picasso et al. [15], la falta de datos específicos sobre este subtipo contribuye a las incertidumbres
respecto a la supervivencia. Por lo tanto, los linfomas primarios y secundarios, aunque
raros, deben ser considerados en el diagnóstico diferencial de las neoplasias mamarias
[1,6,7].
4. Conclusión
Aunque el linfoma folicular primario de mama es una entidad rara, debe ser considerado
en el diagnóstico diferencial de las neoplasias mamarias, sobre todo en mujeres mayores.
El diagnóstico mediante exámenes de imagen es desafiante, lo que hace que el análisis
anatomopatológico e inmunohistoquímico sea esencial para un diagnóstico definitivo.