1. Introduction
Interdigitating dendritic cell sarcoma (IDCS) is a rare hematologic neoplasm with
a complex diagnosis, often confused with other types of neoplasms, which leads to
delayed diagnosis and an unfavorable prognosis for the patient. Here, we present a
case of a 68-year-old female patient, initially suspected of having colon cancer.
However, through histopathological studies, it was determined that she had a lymphoid
neoplasm compatible with the disease described in this case report. This article details
the diagnostic process, oncological management, treatment response, and current status,
as well as a brief review of the topic to help readers understand the medical decisions
made.
2. Case Report
A 68-year-old female patient with a history of hypertension, a colon tumor under investigation,
and current pharmacological treatment with losartan. She also has a history of traumatic
elbow fracture managed with a prosthesis and is a former smoker. She showed up at
the emergency department with a two-month history of progressive abdominal pain associated
with asthenia, adynamia, and pallor. Upon physical examination at admission, the abdomen
showed no distension, positive peristalsis; it was soft, depressible, and tender to
deep palpation in the left hemiabdomen. A palpable, hard, mobile mass was noted in
the left hypochondrium without signs of peritoneal irritation. Hospital admission
was decided for further studies. The patient provided a pathology report from a colonoscopy
biopsy: "Distal ileum biopsies. Benign nodular lymphoid hyperplasia with focal villous
atrophy and moderate chronic ileitis; ascending colon with polypectomy of a tubular
adenoma with low-grade dysplasia." Contrast-enhanced abdominal and pelvic CT scan
revealed retroperitoneal and mesenteric adenopathy suggestive of infiltrative neoplastic
disease, along with thickening of the walls of the right colon. Based on these findings,
inpatient management was deemed necessary. Additional laboratory tests documented
elevated CA125, fibrinogen, and coagulation times. The infectious profile was negative,
and results for folic acid, ESR, reticulocyte percentage, total proteins, and tumor
lysis laboratory values were within normal ranges. Given these findings, an initial
suspicion of lymphoproliferative disease with possible extranodal involvement was
considered. Hematology was consulted, the initial clinical suspicion was confirmed
and further extension studies were recommended, including:
-
July 22, 2021, PET-CT (F18-FDG): Supra- and infra-diaphragmatic hypermetabolic lymphadenopathies,
suggesting glycolytic tumor activity; consideration of lymphoproliferative disease,
diffuse thickening of the right ascending colon wall, and diffuse FDG uptake in the
axial skeleton (Figure 1).
-
July 29, 2021, Flow Cytometry on Bone Marrow: No cell populations were identified
that expressed immunophenotypes associated with hematologic neoplasms.
-
February 2022, Cytogenetics on Bone Marrow:
-
Sample Results: 46, XX
-
Interpretation: No neoplastic clones were detected. This result does not exclude a
hematologic neoplasm.
-
Observation: Occasional chromosomal breaks were noted. A metaphase 92, XXXX, -4, +6,
-8, -11, +16, +17, -19, -19, +22 was observed. No translocations were described.
-
Cell Notes: Estimated resolution of banding: 475.
Pathology Report (September 4, 2021):
-
Macroscopic Description: A paraffin block labeled as BR-1877-21 was received.
-
Microscopic Description: The sections show a bone marrow core with an approximate
cellularity of 40%, with megakaryocytes present and evidence of maturation across
all cell lines. No blasts are observed, and there is no abnormal presence of lymphoid
or plasmacytic populations, which is confirmed by immunoperoxidase markers for CD34,
CD20, CD3, and CD38.
• Diagnosis: Normal hematopoiesis of the three cell lines. Irnmunohistochemistry Report
(September 7, 2021):
• Macroscopic Description: Tissue embedded in paraffin, labeled #1453-21 A1, was received
for study via immunohistochemistry.
• Microscopic Description: The problematic population is positive for CD45, VIMENTIN,
S100, and CD20. It is negative for PANCYTOKERATIN and HMB45. These findings suggest
a lymph node pathology compatible with interdigitating dendritic cell sarcoma of cervical
lymph nodes. The case was reviewed in a pathology board, requiring an expanded marker
panel to exclude other differential diagnoses. Metastases of epithelial and melanocytic
origin were excluded.
• Conclusion: Block #1453-21 A1; Immunohistochemistry: Compatible with INTERDIGITATING
DENDRITIC CELL SARCOMA (IDCS).
With these findings and the relevant clinical analysis, the diagnosis of IDCS was
considered at the time, and treatment was initiated. The patient underwent 6 sessions
of R-CHOP chemotherapy. Flow cytometry in the bone marrow showed aberrant plasma cells
at 0.11%, and a PET-CT (F18-FDG), when compared to the initial study, reported resolution
of supra- and infra-diaphragmatic adenopathy (See Figure 1). The scan also showed an iliac internal chain adenopathy with FDG uptake, surpassing
liver uptake, which, based on Deauville criteria, scored a 4, thus indicating a partial
response to treatment.
Figure 1
Initial PET CT. Hypermetabolic supra (yellow arrow) and infra diaphragmatic (blue
arrow) adenopathy suggest tumor glycolytic activity. Diffuse mural thickening of the
hypermetabolic ascending colon (green arrow) in the clinical context of suspected
lymphoproliferative disease suggests extranodal involvement.
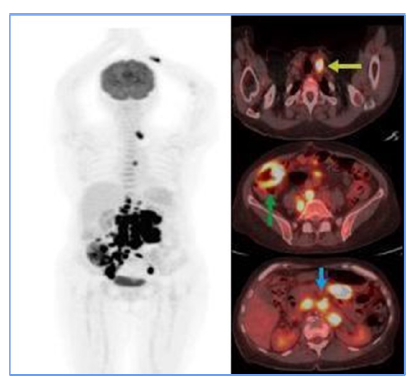
Fuente: Organización Clínica Bonnadona Prevenir, Barranquilla, Atlántico
As a result, the treating hematologist recommended a second-line chemotherapy regimen
(RICE) for 3 cycles. At the end of these sessions, a follow-up PET scan revealed the
resolution of adenopathy in the obturator chain (Figure 3), demonstrating a complete metabolic response. Based on these findings, the patient
was declared in remission. Given the favorable evolution, maintenance immunotherapy
was initiated with a standard-dose Rituximab regimen for low-grade lymphoma, administered
every 2 months for 2 years. As for the writing of this report, the patient has successfully
completed 9 cycles and remains in remission.
Figure 2
PET CT before ICE regimen. Only the right internal iliac chain adenopathy was evident
(green arrow), which showed FDG uptake, exceeding hepatic uptake about score 4 of
the Deauville criteria, suggesting a partial metabolic response to the medical treatment
instituted.
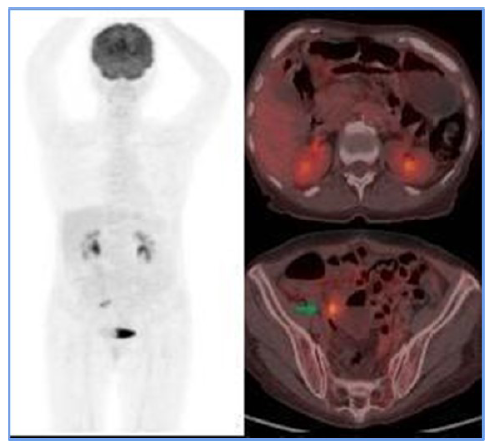
Fuente: Organización Clínica Bonnadona Prevenir, Barranquilla, Atlántico
Figure 3
PET CT scan following the rescue scheme. It presents the resolution of adenopathy
in the proper internal iliac chain, which is related to morphological and metabolic
responses to medical treatment.
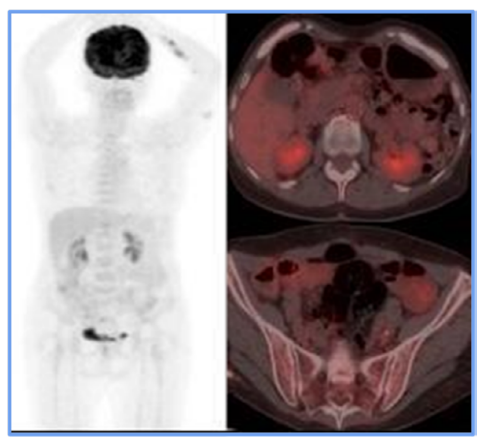
Fuente: Organización Clínica Bonnadona Prevenir, Barranquilla, Atlántico
3. Discussion
Dendritic cells are essential in the immune response, acting as a bridge between the
innate and adaptive immune systems [1]. These cells are classified into follicular,
Langerhans, fibroblastic, and interdigitating types [4]. They are typically found in lymph nodes, the spleen, tonsils, and mucosa-associated
lymphoid tissues (MALT) [2]. Dendritic cells originate in the bone marrow or through migration from Langerhans
cells [4].
Dendritic cell neoplasms (DCNs) are rare, representing less than 1% of lymphoid-origin
tumors [1,6]. DCNs are classified into two main types: stromal dendritic cell neoplasms and myeloid-origin
neoplasms, the latter being the focus of this clinical case [5]. Literature reports describe only about 100-127 cases, predominantly in men over
60 years of age, with high metastasis rates (39%) and an average survival of one year
in advanced stages [2,3,4,5].
Interdigitating dendritic cell sarcoma (IDCS) typically presents as a painless lymphadenopathy,
most commonly in the cervical region, but it has also been described in the axillary,
mediastinal, abdominal, and inguinal regions [5]. The most frequent localization site is the lymph nodes, with a prevalence of 47%,
and 25% of patients present extranodal involvement. Depending on the affected site,
systemic symptoms may be present [2].
The diagnosis of IDCS is complex and requires pathology studies and immunohistochemistry.
Due to its low prevalence, there are no established treatment guidelines. Treatment
options include surgery, radiotherapy, and chemotherapy, depending on the disease
stage [2].
The pathogenesis of IDCS has not been linked to a specific trigger. However, there
have been reports of cases in patients who previously received treatments with Tacrolimus,
suggesting a T-cell malignancy following its dysregulation, facilitating the development
of this type of neoplasm [4]. Histologically, tumor cells are spindle-shaped or histiocytic, with irregular borders,
eosinophilic cytoplasm, and enlarged nuclei. They resemble Langerhans cells microscopically
but lack Birbeck granules and do not express CD1a or langerin [5].
Immunohistochemical studies typically express markers such as S-100, vimentin, HLA-DR,
and CD68. Differential diagnoses include follicular dendritic cell sarcoma, indeterminate
dendritic cell tumor, Langerhans cell sarcoma, anaplastic large cell lymphoma, and
histiocytic sarcoma. One of the most challenging presentations to differentiate is
follicular dendritic cell sarcoma, as both are hematologic neoplasms derived from
similar precursors, sharing morphological and clinical features. However, immunohistochemistry
can help differentiate these entities. Follicular dendritic cell sarcoma expresses
CD21, CD23, and CD35, unlike IDCS. Furthermore, IDCS can mimic non-hematologic neoplasms,
such as sarcomas, carcinomas, or melanomas. Metastatic melanoma, for instance, may
be confused with IDCS due to expression of S-100 and CD68, but it expresses its own
distinct immunohistochemical markers [4].
For staging, PET-CT (F18-FDG) is a crucial tool. Initially, it allowed for documentation
of both nodal and extranodal involvement, establishing tumor viability and aiding
in follow-up and evaluation of treatment response. The Deauville 5-point visual scale
[7] was used to assess treatment response. In this case, the PET-CT documented persistent
disease (Deauville 4), which influenced treatment decisions and led to escalation
of the medical management. A subsequent PET-CT (F18-FDG) performed after rescue therapy
demonstrated a complete metabolic response at the end of treatment [8].
There are no defined treatment guidelines for IDCS due to its low prevalence and unclear
etiopathogenesis. For localized disease in early stages, surgery and/or targeted radiotherapy
may be considered, although no significant survival differences have been found between
surgical and conservative management [5]. In cases with metastatic disease, chemotherapy is usually preferred due to its
systemic reach. Chemotherapy regimens used are typically those directed at non-Hodgkin
lymphoma, though no regimen has been proven superior to others [4].
IDCS prognosis is directly related to the stage at diagnosis. Survival rates are lower
in metastatic stages at the time of treatment initiation [3].
In the case presented here, the patient showed a favorable response to chemotherapy,
achieving complete remission and surviving for two years to date. Lymph node and extranodal
involvement, along with immunohistochemical findings, enabled the diagnosis and timely
treatment initiation (Figure 1). The partial metabolic response observed in the post-treatment PET (Figure 2) led to the decision to escalate the treatment to second-line RICE chemotherapy.
Eventually, a new PET-CT (F18-FDG) post-treatment (Figure 3) confirmed a complete metabolic response.
4. Conclusion
Although IDCS is a very rare pathology due to its similarity to other hematological
neoplasms, it should be considered as a differential diagnosis by exclusion, particularly
when patients present with lymphadenopathy. It has been reported that 19.7% of cases
occur in patients with a previous second malignancy, and in other cases, as a consequence
of certain chemotherapy treatments for breast cancer or immunosuppressive therapies.
However, due to the limited number of disease reports and the scarce information available,
it is not currently possible to determine a clear etiology that explains its origin
[4].
It is important to emphasize the critical role of studies such as histopathology and
immunohistochemistry, which enable distinguishing among differential diagnoses. This
is essential for the timely initiation of treatment, given the poor prognosis of the
disease in advanced stages.
1. Introducción
El sarcoma de células dendríticas interdigitantes (SCDI) es una neoplasia hematológica
rara y de diagnóstico complejo, a menudo confundido con otros tipos de neoplasias,
lo que conlleva un diagnóstico tardío y un pronóstico desfavorable para el paciente.
En este reporte, se presenta el caso de una paciente cerca de su séptima década, en
un inicio con sospecha de tumor de colon, pero mediante estudios histopatológicos
se determinó que cursaba una neoplasia linfoide compatible con la enfermedad del presente
caso. Se describe el proceso diagnóstico, el manejo oncológico, la respuesta al tratamiento
y la situación actual; también se hace una breve revisión del tema que permitirá a
los lectores comprender las decisiones médicas adoptadas.
2. Caso clínico
Mujer de 68 años con antecedentes de hipertensión arterial y tumor de colon en estudio,
tratamiento farmacológico con losartán y complejo B, intervenciones quirúrgicas: tres
cesáreas, trauma: fractura de codo derecho con manejo protésico. Hábito de extabaquista.
Esta paciente acude al servicio de urgencias por presentar cuadro de dos meses de
evolución de dolor abdominal progresivo, asociado a astenia, adinamia y palidez. En
el examen físico de ingreso no presentó distensión abdominal, peristalsis positiva,
blanda, depresible, con dolor a la palpación profunda en hemiabdomen izquierdo. Se
palpa masa en hipocondrio ipsilateral, dura, móvil. Sin signos de irritación peritoneal.
Se decide ingresar para estudios adicionales. Presenta reporte de patología de biopsia
de colonoscopia:
Muestra de íleon distal biopsias N.o 4507-21: Hiperplasia nodular linfoide benigna
con atrofia focal de vellosidades, ileítis crónica moderada, colon ascendente con
polipectomía adenoma tubular con displasia de bajo grado.
TAC abdominopélvico contrastado: "adenomegalias retroperitoneales y mesentéricas relacionadas
a enfermedad neoplásica infiltrante, además de engrosamiento de las paredes del colon
derecho". Por dichos hallazgos se considera manejo intrahospitalario. Se documentó
elevación del CA125 46,3 u/ ml, fibrinógeno y tiempos de coagulación, perfil infeccioso
negativo, ácido fólico, VSG, porcentaje de reticulocitos, proteínas totales y laboratorios
de lisis tumoral normales. Dados sus hallazgos, inicialmente se sospechó de enfermedad
linfoproliferativa, lo que sugería compromiso extranodal. Se interconsulta a hematología;
se reafirma diagnóstico y se amplía con estudios de extensión, entre ellos:
Julio 22 del 2021 PET-CT(F18-FDG): Adenopatías supra e infra diafragmáticas hipermetabólicas,
sugieren actividad glicolítica tumoral, considerar enfermedad linfoproliferativa,
engrosamiento mural difuso del colon ascendente hipermetabólico y captación difusa
a la FDG en el esqueleto axial (Figura 1).
Julio 29 del 2021 citometría de flujo en médula ósea: No se identificaron poblaciones
celulares que expresen inmunofenotipo vinculable con neoplasia hematológica. Inmunohistoquímica
de la biopsia N.o 1635-2021 de ganglios hallazgos compatibles con sarcoma de células
dendríticas interdigitantes reticulares de ganglios cervicales.
Febrero del 2022 citogenético en médula ósea:
• Resultados de la muestra: 46, XX
• Interpretación: No se detectaron clones neoplásicos. Este resultado no descarta
neoplasia hematológica.
• Observación: Ocasionales rupturas cromosómicas. Se observó una metafase 92,XXXX,
-4, +6, -8, -11, +16, +17, -19, -19, +22. No se describen traslocaciones.
• Notas de célula: Resolución estimada de bandeamiento: 475.
Biopsia de médula ósea:
Reporte de anatomía patológica (04 de septiembre del 2021)
• Descripción macroscópica: Se recibe un bloque de parafina rotulado como BR-1877-21.
• Descripción microscópica: Los cortes muestran cilindro de médula ósea con una celularidad
aproximada del 40 %, megacariocitos presentes con evidencia de todas las líneas celulares
de maduración. No se reconoce blastos ni hay presencia anormal de población linfoide
o plasmática lo cual se corrobora con marcadores por inmunoperoxidasas para CD34,
CD20, CD3 y CD38.
• Diagnóstico: Hematopoyesis de las tres líneas.
Reporte de inmunohistoquímica (07 de septiembre del 2021)
• Descripción macroscópica: Se recibe tejido incluido en parafina rotulado #1453-21
A1, para estudio mediante técnica de inmunohistoquímica.
• Descripción microscópica: La población problema es positiva para CD45, VIMENTINA,
S100 y CD20. Negativa para PANCITOQUERATINA, HMB45. Lo anterior plantea patología
del ganglio linfático de tipo sarcoma de células dendríticas interdigitantes reticulares.
Caso visto en junta de patología, requiere ampliación del panel de marcadores para
excluir otros diferenciales. Se excluyeron metástasis de estirpe epitelial y melanocítica.
• Conclusión: Bloque #1453-21 A1; inmunohistoquímica. Compatible con sarcoma de células
dendríticas interdigitantes reticulares.
Con dichos hallazgos y el análisis clínico pertinente, se consideró en su momento
que la paciente cursaba con SCDI, y posterior a esto se indicó su manejo. Por tal
motivo, se ordenaron seis sesiones de poliquimioterapia R-CHOP. Eventualmente se realizó
citometría de flujo en médula ósea: células plasmáticas aberrantes del 0,11 %, y un
PET-CT (F18-FDG), que, en comparación con el estudio inicial, reportó resolución de
las adenopatías supra e infradiafragmáticas (ver Figura 1).
Figura 1
Initial PET CT. Hypermetabolic supra (yellow arrow) and infra diaphragmatic (blue
arrow) adenopathy suggest tumor glycolytic activity. Diffuse mural thickening of the
hypermetabolic ascending colon (green arrow) in the clinical context of suspected
lymphoproliferative disease suggests extranodal involvement.
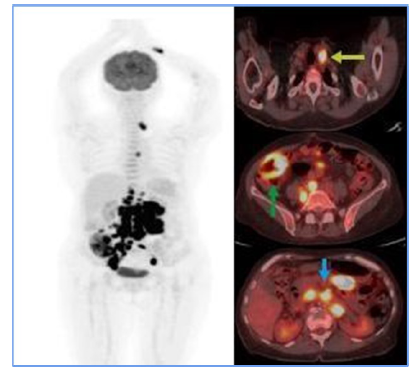
Fuente: Organización Clínica Bonnadona Prevenir, Barranquilla, Atlántico
En este reporte era evidente la adenopatía en cadena ilíaca interna derecha, que mostraba
captación a la FDG, y superaba la captación hepática, la cual en relación con los
criterios de Deauville correspondía a un puntaje de 4, lo que indica una respuesta
parcial al tratamiento [1]. Por lo tanto, el hematólogo tratante indicó manejo de rescate con esquema de quimioterapia
de segunda línea: ICE por 3 ciclos. Al finalizar estas sesiones, se realizó un nuevo
PET que reportó resolución de adenopatía en cadena obturatriz (Figura 3). Se evidenció una respuesta metabólica completa, y con estos hallazgos se declara
al paciente en estado de remisión de su enfermedad. Hematología, ante su adecuada
evolución, instaura inmunoterapia de mantenimiento con rituximab a dosis estándar
cada dos meses por dos años. Al momento de realizar este documento, la paciente ha
cursado nueve ciclos de manera exitosa y continúa en remisión de su enfermedad.
Figura 2
Tomografía computarizada por emisión de positrones (PET) antes del régimen de ECI.
Solo se evidenció la adenopatía de la cadena ilíaca interna derecha (flecha verde),
la cual mostró captación de FDG, superior a la captación hepática alrededor del puntaje
4 de los criterios de Deauville, sugiriendo una respuesta metabólica parcial al tratamiento
médico instaurado.
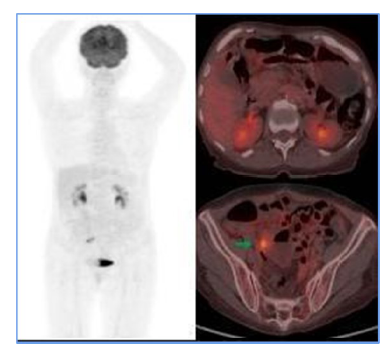
Fuente: Organización Clínica Bonnadona Prevenir, Barranquilla, Atlántico
Figura 3
PTomografía computarizada PET siguiendo el esquema de rescate. Se presenta la resolución
de la adenopatía en la cadena ilíaca interna propia, la cual se relaciona con las
respuestas morfológicas y metabólicas al tratamiento médico.
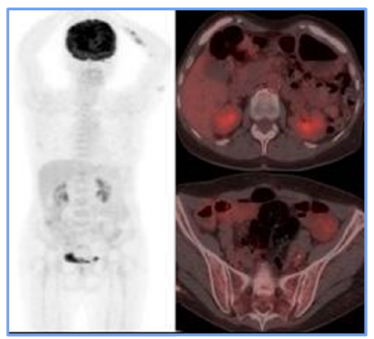
Fuente: Organización Clínica Bonnadona Prevenir, Barranquilla, Atlántico
3. Discusión
Las células dendríticas son esenciales en la respuesta inmune; actúan como un puente
entre los sistemas inmune innato y adaptativo [2]. Estas se clasifican en foliculares, de Langerhans, fibroblásticas e interdigitantes
[3]. Se puede encontrar dichas células ubicadas en ganglios linfáticos, en el bazo,
en las amígdalas y en tejidos linfoides asociados a mucosas (MALT) [4]. Se originan en la médula ósea o en la migración de células de Langerhans [3].
Las neoplasias de células dendríticas (NCD) son raras, estas representan menos del
1 % de los tumores ganglionares [2,5]. Las NCD se clasifican en dos tipos principales: neoplasias dendríticas estromales
y de origen mieloide; esta última es el foco de este caso clínico [6]. En la literatura solo se han descrito al menos entre 100-127 casos, sobre todo
en hombres mayores de 60 años, asiáticos y caucásicos, con alta tasa de metástasis
(39 %) y una supervivencia promedio de un año en estadios avanzados [3,4,6,7].
El SCDI suele presentarse inicialmente como una adenopatía indolora, localizada por
lo general en la región cervical; también se han descrito en región axilar, mediastinal,
abdominal e inguinal [5]. El sitio de localización más frecuente son los ganglios linfáticos con una prevalencia
de 47 %, y un 25 % de los paciente presenta compromiso extraganglionar, en el que,
por su localización, se podrían presentar síntomas sistémicos, según el lugar afectado
[4].
El diagnóstico es complejo y requiere estudios de patología e inmunohistoquímica.
Su tratamiento no sigue guías definidas debido a su baja prevalencia. Las opciones
incluyen cirugía, radioterapia y quimioterapia, según el estadio de la enfermedad
[4].
El SCDI no ha sido relacionado a un factor desencadenante específico; sin embargo,
se han reportado casos de esta patología en pacientes que recibieron tratamientos
previos con tacrolimus. Esto sugiere una malignización de los linfocitos T tras su
desregulación, y facilita el desarrollo de este tipo de neoplasia [3]. En cuanto a su parte histopatológica, son células fusiformes o histiocitoides con
bordes irregulares, eosinofílicas con núcleos agrandados. Se parecen a las células
de Langerhans microscópicamente, pero sin gránulos de Birbeck. Así como tampoco expresan
CD1a y langergina [6].
Los estudios de inmunohistoquímica usualmente expresan moléculas como el S-100, vimentina,
HLA-DR y CD68. Dentro de los diagnósticos diferenciales se encuentra el sarcoma de
células dendríticas foliculares, tumor de células dendríticas indeterminadas, sarcoma
de células de Langerhans, linfoma anaplásico de células grandes y el sarcoma histiocítico.
Entre los más difíciles de diferenciar se encuentra el sarcoma de células dendríticas
foliculares, ya que, al ser una neoplasia hematológica proveniente de un precursor
similar, comparten características morfológicas y clínicas que dificultan el diagnóstico.
Sin embargo, la inmunohistoquímica ayuda a determinarlo, pues el sarcoma de células
foliculares expresa CD21, CD23 y CD35, a diferencia del SCDI. El SCDI tiene la capacidad
de imitar neoplasias no hematológicas, como algunos sarcomas, carcinomas o melanomas
[3]. El melanoma metastásico es confundido con esta enfermedad, al expresar S-100 y
CD68 [6]; aunque expresa sus propios marcadores inmunohistoquímicos que lo diferencian [3].
Para la estadificación, se utilizó como herramienta el PET-CT (F18-FDG), que juega
un papel importante, ya que en primera instancia permitió documentar el compromiso
tanto ganglionar como extranodal y establecer viabilidad tumoral; además, facilitó
el seguimiento imagenológico y la evaluación de respuesta al tratamiento médico, mediante
la escala visual análoga Deauville de 5 puntos [1]. Para este caso, el PET CT documentó enfermedad persistente (Deauville 4), y contribuyó
a la toma de decisiones que incluyeron el escalonamiento del manejo médico instaurado.
Para un segundo momento, un nuevo PET-CT (F18-FDG) realizado después del manejo de
rescate documentó que la paciente tuvo una respuesta metabólica completa al final
del tratamiento [8].
Para el tratamiento no existen guías definidas, dada su baja prevalencia y su etiopatogenia
no clara. En estadios iniciales localizados, se puede optar por cirugía o radioterapia
dirigida, a pesar de que no se han descrito diferencias significativas en la sobrevida
de los pacientes sometidos a manejo quirúrgico en comparación con el manejo conservador
[6]. En los casos en que la enfermedad se encuentra metastásica, suele preferirse la
quimioterapia por su alcance sistémico. Se utilizan esquemas dirigidos a enfermedades
como el linfoma No-hodgkin; aunque, a pesar de los distintos esquemas propuestos,
no hay una superioridad descrita de uno sobre los demás [3].
El pronóstico de la enfermedad es directamente proporcional a su avance al momento
del diagnóstico. Su supervivencia es menor en estadios metastásicos al inicio del
tratamiento [7].
En este caso, la paciente presentó una respuesta favorable al tratamiento quimioterapéutico,
logró una remisión completa y una supervivencia de dos años hasta la fecha. El compromiso
ganglionar y extranodal y los hallazgos de inmunohistoquímica permitieron diagnosticar
la enfermedad y realizar tratamiento médico oportuno (Figura 1). Se obtuvo una respuesta metabólica parcial, documentada en el PET posterior al
manejo inicial (Figura 2), por lo que se decidió escalar al esquema ICE de rescate de segunda línea. Se realizó
un nuevo PET CT (F18-FDG) postratamiento (Figura 3), que permitió establecer respuesta metabólica completa.
4. Conclusión
A pesar de ser una patología muy rara, dada su similitud con otras neoplasias hematológicas,
debe ser tomada en consideración como diagnóstico diferencial por exclusión; sobre
todo cuando presentan adenopatías. Se ha descrito que un 19,7 % de los casos se encuentran
cursando una segunda neoplasia previa a este sarcoma y en otros casos como consecuencia
de ciertos tratamientos de quimioterapia para cáncer de mama o inmunosupresores, pero
que, de momento, al ser escasos los reportes de la enfermedad y la información sobre
esta, no es posible determinar una etiología clara que explique su origen [4].
Cabe destacar la importante realización de estudios tales como la histopatología e
inmunohistoquímica, pues permiten discernir entre los diagnósticos diferenciales,
y así iniciar un tratamiento oportuno, dado el mal pronóstico de la enfermedad en
casos avanzados.