Disease Free Survival and Overall Survival in Triple-Negative Breast Cancer Patients
with Post-Neoadjuvant Residual Disease Treated with Adjuvant Capecitabine Capecitabine in breast cancer
Article / Artículo
https://doi.org/10.33821/745
Date received: 02/5/2024
Date accepted: 12/8/2024
1. Introduction
Breast cancer is the most common cancer and specific cause of death among women living
in Latin America and Caribbean region with 200,000 new cases and more than 52,000
deaths per year (1). It is also located in the first place of incidence for Colombia with 15,509 cases
and a mortality of 4,411 cases by 2020 (2). Among all new cases of breast cancer, triple negative breast cancer (TNBC) occurs
at a frequency from 15% to 20% (3).
The high heterogeneity, aggressiveness and absence of a receptor that acts as a target
for the development of new drugs explain the fact that CMNT is the subtype with the
least favorable clinical results and with the smallest number of effective therapeutic
options (3).
Although some inhibitors have proven to be effective in the neoadjuvant phase, their
high price and not very good cost-effectiveness mean that from the perspective of
payers, these inhibitors at their current price will probably not be the choice for
patients with TNBC (4). This is why chemotherapy continues to be the cornerstone of treatment, both neoadjuvant
and adjuvant. In the neoadjuvant setting, chemotherapy is typically administered with
the goal of shrinking the tumor and potentially achieving a better surgical outcome,
as well as evaluating the patient's prognosis (5). Currently, the standard chemotherapy for the treatment of TNBC is represented by
the sequence of taxanes (docetaxel/paclitaxel) and anthracycline (6-10).
However, even though the chemotherapy regimen is effective, the 10-year risk of relapse
of TNBC ranges between 20 and - 40% (11); therefore, it is necessary to explore the role of new chemotherapy agents and regimens
to obtain important benefits in the survival of these patients.
Capecitabine is a nucleoside analogue -commonly used in patients with metastatic breast
cancer -whose role in the treatment of TNBC has aroused special interest (11,12).
Several studies have analyzed the role of Capecitabine in the treatment of TNBC and
obtained heterogeneous results. The CREATE-X study evaluated the role of Capecitabine
in relation to DFS in patients with triple negative disease, the DFS rate was 69.8%
in the Capecitabine group versus 56.1% in the control group (HR 0 .58; 95% CI, 0.39
to 0.87), and the OS rate was 78.8% versus 70.3% (hazard ratio for death, 0.52; 95%
CI, 0.30 to 0.90) (13). The GEICAM/2003-11-CIBOMA/2004-01 study explored adjuvant Capecitabine after standard
chemotherapy in patients with early TNBC, but this study failed to show a statistically
significant increase in DFS when adding Capecitabine to standard chemotherapy in patients
with early TNBC (14).
Considering the contradictory results and the absence of data from Latin American
populations on the effect of neoadjuvant Capecitabine in patients with TNBC, it is
necessary to provide new evidence that allows drawing conclusions and individualizing
treatment options for these patients.
The primary objective of this study was to evaluate the progression-free survival
(PFS) of patients with stage I-III triple-negative breast cancer with postneoadjuvant
residual disease, treated with Capecitabine, in an oncology reference center in the
city of Medellín. As a secondary objective, overall survival (OS) was evaluated in
these patients.
2. Materials and methods
The protocol of this study was approved by the institutional ethics committee for
research in human beings of the CES University (cod. Acta211Proy973) and by Fundación
Colombiana de Cancerología Clínica Vida (FCCCV). Since this is a retrospective study,
without any intervention in the care of the patients, the informed consent used for
research studies at the institution was not required. Patient data were guaranteed
to be submitted anonymously and confidentially. The reporting of results follows the
recommendations of the STROBE guideline (15).
2.1. Design and context
Observational follow-up study of a cohort from April 15, 2018 to April 27, 2023, until
death or administrative censorship, based on records taken from the database of the
Fundación Colombiana de Cancerología Clínica Vida (FCCCV) of Medellín between 2019
and 2023. Data collection was carried out from February 15, 2023 to May 18, 2023;
mortality of all patients was evaluated on June 6, 2023 on the Adres platform (16). The Administrator of the Resources of the General Social Security Health System
(ADRES by its Spanish acronym) is the State entity in which the population's records
are located, including their date of death.
2.2. Participants
From the information provided by the FCCCV, a total of 144 records of patients who
were prescribed Capecitabine at the institution were reviewed. Patients were included
in the study if they met the following criteria: women over 18 years of age, with
triple negative breast cancer, stage I-III, with residual disease after neoadjuvant
chemotherapy, and who received Capecitabine as adjuvant monotherapy. The exclusion
criteria were bilateral breast cancer, multiple synchronous cancers, previous treatment
with oral Fluoracil, pregnant and lactating patients. Patients whose records had more
than 10% of missing data were also excluded.
2.3. Triple negative breast cancer
The triple negative subtype was defined as hormone receptor negativity by immunohistochemistry
and Her2 negative by immunohistochemistry (Her2 0 or 1+) or FISH (in situ hybridization) test in cases of equivocal Her2 (2+).
2.4. Variables
The primary outcome variable was OS, which was calculated from the time of treatment
initiation to the last follow-up or time of death from any cause. PFS was a secondary
outcome variable that was calculated from the time of treatment initiation until progression
was documented or to the last follow-up without evidence of progression. The initial
characteristics of the patients were considered; age, menopausal status, tumor size,
axillary lymph node involvement, neoadjuvant chemotherapy regimen received, surgery
performed, as well as characteristics of residual disease focused on Residual Tumor
Burden (RCB).
2.5. Data sources
The FCCCV IT team was asked for the list of patients admitted between 2019 to 2023
for TNBC, treated with adjuvant Capecitabine, subsequently a review of the medical
history of each patient was carried out to determine who met the inclusion criteria
and thus obtain the data of interest for the study.
To determine the diagnosis, the date of the first histopathological study was taken.
For progression, the date of the first imaging study that showed locoregional or distant
change was recorded. Finally, the cut-off date to evaluate survival was June 6, 2023,
for all patients by checking their activity status on the Adres platform (16).
2.6. Bias control
Data collection was carried out by a researcher who verified in each clinical record
that the inclusion requirements were met and entered them in the corresponding Excel
template where each variable of interest was stipulated. In case of doubt about any
variable record, it was consulted with expert researchers in the area (mastologist,
oncologist or epidemiologist).
The clinical record was initially reviewed, if it lacked information or was incomplete,
the mastology evaluations were verified and in cases in which none was available,
the data were extracted from the notes of the other specialties related to breast
care of the patient due to their oncological condition (pain and palliative care or
oncological rehabilitation).
2.7. Statistical methods
A univariate analysis was performed to characterize the study population considering
the nature of the variables. In the case of quantitative variables, the Kolmogorov-Smirnov
normality test was performed to define whether they presented averages or medians.
Qualitative variables were analyzed using absolute and relative frequencies. Median
survival was calculated using the Kaplan Meier curve.
For the bivariate analysis, differences in survival according to covariates were calculated
by the log Rank test.
A multivariate analysis was performed through the association between covariates and
time to event using COX regression. A p value less than 0.05 was considered statistically
significant. All analyzes were performed in SPSS version 25.
3. Results
3.1. Participants
A total of 41 patients met the inclusion criteria. With a median age of 55 (44.5-65.5)
years old. Of them, 25 (61%) were postmenopausal and only 16 (39%) were premenopausal.
The most common histological subtype was invasive ductal carcinoma in 39 people (95.1%).
T4b was the most common staging of the patients in 14 (36.6%). The initial descriptive
data of the patients are presented in Table 1.
Table 1
Baseline characteristics of patients with triple-negative breast cancer with postneoadjuvant
residual disease
|
Characteristics
|
N (%)
|
|
Age
|
|
|
Median (Interquartile Range)
|
55(44.5-65.5)
|
|
Menopausal status
|
|
|
Premenopausal
|
16 (39)
|
|
Postmenopausal
|
25 (61)
|
|
Tumor histology
|
|
|
Ductal
|
39 (95.1)
|
|
Lobular
|
1 (2.4)
|
|
Other
|
1 (2.4)
|
|
Tumor size at diagnosis
|
|
|
≤2cm
|
2 (4.8)
|
|
2.1-5cm
|
16 (39)
|
|
≥5.1cm
|
23 (56.1)
|
|
Prior t
|
|
|
T2
|
11 (26.8)
|
|
T3
|
14 (34.1)
|
|
T4b
|
15 (36.6)
|
|
T4c
|
1 (2.4)
|
|
Histological grade
|
|
|
1
|
1 (2.4)
|
|
2
|
10 (24.4)
|
|
3
|
30 (76.2)
|
|
Ki67, Median (Interquartile Range)
|
60 (40-80)
|
|
Focality
|
|
|
Unifocal
|
38 (92.7)
|
|
Multifocal
|
2 (4.9)
|
|
Multicentric
|
1 (2.4)
|
|
Lymph node involvement
|
|
|
No
|
9 (31)
|
|
Yes
|
32 (78)
|
|
Neoadjuvant received
|
|
|
Anthracyclics + Taxanes
|
36 (87.8)
|
|
Taxanes
|
1 (2.4)
|
|
Docetaxel + cyclophosphamide
|
1 (2.4)
|
|
Taxanes and platinum
|
3 (7.3)
|
|
Surgery on breast
|
|
|
Conservative surgery
|
13 (31.7)
|
|
Mastectomy
|
28 (68.2)
|
|
Axillary surgery performed
|
|
|
BGC
|
7 (17.1)
|
|
BGC + VA
|
1 (2.1)
|
|
GOES
|
27 (65.9)
|
|
Without axillary surgery
|
6 (14.6)
|
|
Adjuvant radiotherapy
|
40 (97.6)
|
3.2. Response to neoadjuvant chemotherapy and Capecitabine
In 70% of cases, chemotherapy management consisted of the use of doxorubicin (60 mg/m2)
plus cyclophosphamide (600 mg/m2) every 21 days with support of granulocyte colony-stimulating
factors in each cycle, followed by Paclitaxel (80 mg/m2) weekly for 12 weeks. Only
22% received a regimen with anthracyclines in dense doses (every 14 days) due to access
barriers. The use of platinum in neoadjuvant treatment was carried out in 68% of cases
in conjunction with paclitaxel.
The most common neoadjuvant chemotherapy regimen was anthracyclic plus taxanes in
36 patients (87.8%), the other regimen used in 3 patients (7.3%) was taxanes plus
platinum, as described in Table 1.
In eight patients (19.5%), the pathology of the surgical specimen reported RCB 1,
in 20 patients (48.8%) RCB 2, and only 13 (31.7%) reported RCB 3. Table 2 shows the characteristics of the patients after neoadjuvant treatment.
Table 2
Response to neoadjuvant chemotherapy in patients with triple-negative breast cancer
with post-neoadjuvant residual disease
|
Characteristics
|
N (%)
|
|
RCB
|
|
|
1
|
8 (19.5)
|
|
2
|
20 (48.8)
|
|
3
|
13 (31.7)
|
|
Residual tumor size (mm)
|
|
|
Median (Interquartile Range)
|
23 (10-36)
|
|
ypt
|
|
|
ypT0
|
1 (2,4)
|
|
ypT1a-ypT4c
|
40 (97.6)
|
|
Positive lymph nodes
|
|
|
0
|
23 (56.1)
|
|
1-3
|
12 (29.3)
|
|
≥4
|
6 (16.6)
|
|
Nodal metastasis size (mm), median (IQR)
|
2.63 (0-3)
|
|
Tumor bed size (mm), median (IQR)
|
23 (11.50-38.50)
|
|
Postneoadjuvant cellularity (%), median (IQR)
|
50 (12.50-65)
|
|
Residual DCIS (%), median (IQR)
|
1 (0-20)
|
|
Progression
|
|
|
No
|
30 (76.2)
|
|
Yes
|
11 (26.8)
|
|
Progression site
|
|
|
Regional
|
2 (18.1)
|
|
Loco-regional
|
2 (18.1)
|
|
Distance
|
7 (63.6)
|
|
Remote progression site
|
|
|
CNS
|
1 (2,4)
|
|
Lungs
|
2 (4.9)
|
|
Ganglion
|
2 (4.9)
|
|
Bones
|
2 (4.9)
|
|
Death
|
|
|
No
|
37 (90.2)
|
|
Yes
|
4 (9.8)
|
3.3. Progression-Free Survival
Median PFS was 25.03 months (95% CI, 13.37 - 36.68), see Figure 1. Eleven patients (26.8%) presented disease progression after starting adjuvant treatment
with Capecitabine. Among the total of patients who presented progression, distant
progression was documented in seven patients (63.6%), regional progression in 2 (18.1%),
and loco-regional progression in 2 (18.1%), as described in Table 2. The most frequent distant progression was lymph node progression in 2 patients (2.9%),
followed by metastasis to the lung and bones, both groups with the same representation
of 2 patients (4.9%). Among the patients with progression, four died from this cause.
When performing the multivariate analysis (Table 3), the statistically significant characteristics associated with patients who received
adjuvant Capecitabine were postmenopausal status as a protective factor for progression
(HR0.32, 95% CI 0.09 -0.98, p 0.045), and a larger previous size presented a greater
risk of disease progression over time (HR1.69, 95% CI, 1.02-2.81, p =0.041).
Figure 1
Progression-free survival in triple-negative breast cancer patients with postneoadjuvant
residual disease who received adjuvant Capecitabine
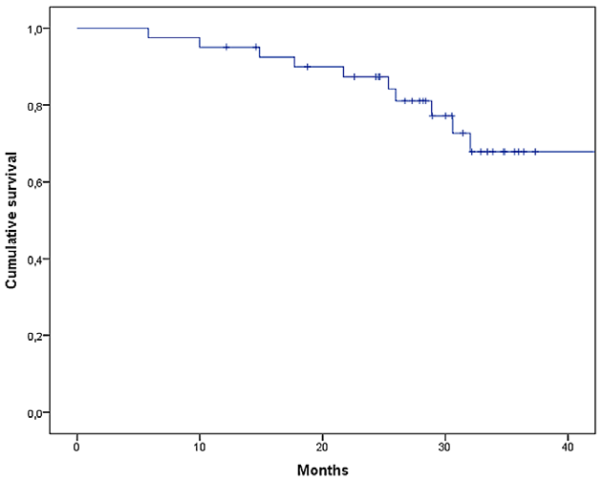
Table 3
Factors associated with time to progression in patients treated with Capecitabine
|
Variable
|
Univariate
|
Multivariate
|
|
RH 95%(CI)
|
p value
|
RH 95%(CI)
|
p value
|
|
Age
|
0.97 (0.93-1.01)
|
0.162
|
|
|
|
Menopause
|
0.32 (0.09-0.98)
|
0.045
|
|
|
|
Ki67
|
0.98 (0.95-1.01)
|
0.347
|
|
|
|
Prior t
|
1.69 (1.02-2.81)
|
0.041
|
1.69 (1.02-2.81)
|
0.041
|
|
Previous lymph node involvement
|
3.02 (0.38-23.94)
|
0.294
|
|
|
|
Breast surgery (mastectomy/conservative)
|
0.77 (0.23-2.56)
|
0.681
|
|
|
|
Affected lymph nodes
|
|
|
|
|
|
0
|
ref
|
0.039
|
|
|
|
1 to 3
|
1.63 (0.36-7.38
|
|
|
|
4
|
3.85 (1.10-13.39)
|
|
|
|
Size of the largest lymph node
|
1.04 (0.98-1.12)
|
0.158
|
|
|
|
RCB
|
|
|
|
|
|
1
|
ref
|
0.208
|
|
|
|
2
|
0.47 (0.06-3.42)
|
|
|
|
3
|
1.95 (0.39-9.72)
|
|
|
|
Focality
|
|
|
|
|
|
Multifocal or multicentric/unifocal
|
0.04 (0.01-9.70)
|
0.854
|
|
|
|
NACT
|
|
|
|
|
|
(Taxanes + platinum /Anthracyclines + taxanes)
|
2.76 (0.71-10.61)
|
0.139
|
|
|
|
YpT (ypT1a-ypT4c/Yp0)
|
2.13 (0.62-7.28)
|
0.228
|
|
|
3.4. Overall survival
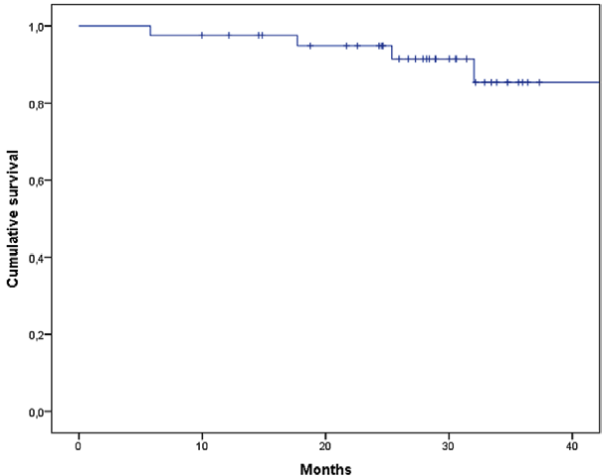
The mean OS was 50.37 months (95% CI, 45.3-55.5) (Figure 2). When performing the survival analysis by RCB, it was found that the mean OS was
51, 50, and 46 months for RCB 1, RCB 2, and RCB 3, respectively; this difference was
not statistically significant (p = 0.614). according to the different neoadjuvant
schemes or the type of surgery performed.
Figure 2
Overall survival in triple-negative breast cancer patients with postneoadjuvant residual
disease who received adjuvant Capecitabine
4. Discussion
In Colombia, there is no clear characterization -retrospective or prospective- of
patients with post-neoadjuvant residual disease that evaluates the possible effect
of Capecitabine on the OS of the affected people. Therefore, this protocol aimed to
objectively and retrospectively evaluate the characteristics of this group of patients
and their behavior regarding PFS and OS. Forty-one patients were analyzed, of which
26% presented disease progression at 36 months and, out of them, four died from this
cause.
The patients in this study had a median age of 55 years (IQR 44.5-65.6), similar to
the Create -82 years of the patients of GEICAM/2003-11_CIBOMA/2004-01 (14). When comparing our results with those studies mentioned above, we observed that
the overall survival in them was 94% at 5 years in the group that received Capecitabine
(13), which is higher when compared with our study, with an OS of 80.6% at 3 years. In
the GEICAM/2003-11_CIBOMA/2004-01 study, the 5-year OS in the Capecitabine group was
86.2% (13), although these results are lower. Therefore, in future prospective studies in our
population, it will be necessary to evaluate what unfavorable characteristics are
present. One of these characteristics could be that in our study 35.5% were tumors
that affected the skin and/or chest wall, in the Create 11 CIBOMA/2004-01 no specification
of that characteristic is made. Regarding tumor size, 56.1% had tumors larger than
5 cm, while in Create, in the multivariate analysis, which indicates that our cohort
represents a group of patients with more aggressive initial characteristics, and therefore
their prognosis would be less favorable despite the use of adjuvant Capecitabine.
In our study, 54.5% of the patients who presented progression were premenopausal.
This variable was not evaluated in Create (95% CI, 0.639 - 1.176).
One of the focuses of the study was to evaluate the impact of RCB in terms of prognosis;
however, we did not find statistically significant differences in both PFS and OS
among groups RCB 1, RCB 2, and RCB 3. When performing the survival analysis by RCB,
it was found that the mean survival was 51, 50, and 46 months for RCB 1, RCB 2, and
RCB 3, respectively, and this was not statistically significant p 0.614. The Create
X and GEICAM/2003-11_CIBOMA/2004-01 studies did not evaluate these variables.
In the meta-analysis carried out by Yan Li and collaborators in 2019, the efficacy
of Capecitabine as adjuvant chemotherapy for early-stage TNBC treated with taxane/anthracycline-based
chemotherapy was evaluated. They found a significant increase in DFS with the addition
of Capecitabine (hazard ratio [HR] = 0.77, 95% CI: 0.66-0.90); a significant improvement
in DFS was observed in trials involving six to eight cycles of Capecitabine addition.
Furthermore, in a meta-analysis of six trials, a significant increase in overall survival
was detected in the Capecitabine group (HR=0.69, 95% CI: 0.56-0.85) (17).
In the neoadjuvant treatment of TNBC, anthracyclines such as doxorubicin and epirubicin
are used in dense doses in combination with cyclophosphamide. This approach, known
as dose-dense chemotherapy, involves giving anthracyclines at shorter intervals than
usual, for instance, every two weeks instead of every three weeks. Dose-dense chemotherapy
has been shown to improve pathologic complete response rates, increase disease-free
survival, and overall survival compared with standard chemotherapy in some studies
(18-22). However, in our study only 22% of patients received this regimen due to barriers
to access. Additionally, dose-dense chemotherapy may also be associated with a higher
risk of side effects such as febrile neutropenia, which requires support with granulocytic
colony factors to reduce this risk of complications (18-21).
The use of immunotherapy, and especially pembrolizumab, has been explored in the neo-
and adjuvant management of triple-negative breast cancer (23). The KEYNOTE-522 study evaluated the safety and efficacy of pembrolizumab in combination
with neoadjuvant chemotherapy followed by pembrolizumab as adjuvant therapy in patients
with early-stage TNBC (24-25). The study included 1174 treatment-naïve patients with stage II or III TNBC and
were randomly assigned to receive neoadjuvant chemotherapy with carboplatin/paclitaxel
and anthracyclines with or without pembrolizumab. After surgery, patients received
pembrolizumab or placebo as complementary adjuvant therapy for one year. The study
showed that the addition of pembrolizumab to neoadjuvant chemotherapy increased the
overall pCR rate from 51 to 65 percent independent of PD-L1 expression (24-25).
At follow-up, the addition of pembrolizumab improved 36-month DFS (85% with pembrolizumab
versus 77% with placebo), with a 37% reduction in events (HR 0.63, 95% CI 0.48-0 ,82)
(25). DFS with the addition of pembrolizumab had a greater absolute benefit in patients
who did not achieve pCR with NACT than in patients who achieved pCR (94 versus 92
percent), thus raising the need for additional adjuvant therapy in patients with post-neoadjuvant
residual disease. Capecitabine can potentially be combined with pembrolizumab in this
subgroup; however, the study did not contemplate the addition of Capecitabine in these
cases and we still need to wait for mature results from this long-term study in this
regard. In our country, treatment with immunotherapy (pembrolizumab) is not available
for use in this indication.
This study was observational, with the inherent limitations of this type of design.
Results of this study enabled a comparison with international publications about the
population characteristics and the benefit of treatment with Capecitabine in this
group of patients. However, we found that in this group, in which OS and PFS were
analyzed, results were similar to international studies. An important limitation was
not having a control group to which Capecitabine was not prescribed as neoadjuvant
chemotherapy.
5. Conclusions
Favorable results were observed in patients with triple-negative breast cancer with
post-neoadjuvant residual disease with adjuvant Capecitabine, particularly in postmenopausal
patients with smaller previous size, regardless of the RCB, since they presented better
PFS and OS. More studies are needed to make a comparison between patients who received
adjuvant Capecitabine and others who did not receive another regimen.
1. Introducción
El cáncer de mama es el cáncer más frecuente y causa de muerte específica entre las
mujeres que viven en la región de América Latina y el Caribe, con 200 000 nuevos casos
y más de 52 000 muertes por año [1]. También se ubica en el primer lugar de incidencia para Colombia con 15 509 casos
y una mortalidad de 4411 casos para el 2020 [2]. Entre todos los casos nuevos de cáncer de mama, el cáncer de mama triple negativo
(CMTN) ocurre con una frecuencia de entre el 15 y el 20 % [3].
La alta heterogeneidad, agresividad y la ausencia de un receptor que actúe como blanco
para el desarrollo de nuevos fármacos explican el hecho de que el CMNT sea el subtipo
con los resultados clínicos menos favorables y con el menor número de opciones terapéuticas
eficaces [3].
A pesar de que algunos inhibidores han probado ser eficaces en la fase neoadyuvante,
su alto precio y su no muy buena relación costo-efectividad hacen que, desde la perspectiva
de los pagadores, estos inhibidores no sean la elección probable para pacientes con
CMTN [4]. Por tanto, la quimioterapia sigue siendo aún la piedra angular del tratamiento,
tanto neoadyuvante como adyuvante. En el contexto neoadyuvante, la quimioterapia suele
administrarse con el fin de reducir el tamaño del tumor y lograr potencialmente un
mejor resultado quirúrgico, así como para evaluar el pronóstico del paciente [5]. Actualmente, la quimioterapia estándar para el tratamiento del CMTN está representada
por la secuencia de taxanos (docetaxel/paclitaxel) y antraciclina [6-10].
No obstante, a pesar de que el régimen de quimioterapia sea efectivo, el riesgo de
recaída a diez años del CMTN oscila entre un 20 y un 40 % [11], así que es necesario explorar el papel de nuevos agentes y regímenes de quimioterapia
con el fin de obtener beneficios importantes en la supervivencia de estas pacientes.
La capecitabina es un análogo de los nucleósidos, utilizado habitualmente en pacientes
con cáncer de mama metastásico y cuyo papel en el tratamiento del CMTN ha suscitado
un especial interés [11,12].
Varios estudios han analizado el papel de la capecitabina en el tratamiento del CMTN
y se han obtenido resultados heterogéneos. El estudio CREATE-X evaluó el papel de
la capecitabina con relación a la supervivencia libre de enfermedad (SLE) en pacientes
con enfermedad triple negativa, la tasa de SLE fue del 69,8 % en el grupo de capecitabina
frente al 56,1 % del grupo de control (HR 0,58; IC del 95 %, 0,39 a 0,87), y la tasa
de supervivencia global (SG) fue de 78,8 % frente al 70,3 % (cociente de riesgo de
muerte, 0,52; IC del 95 %, 0,30 a 0,90) [13]. El estudio GEICAM/2003-11-CIBOMA/2004-01 exploró la capecitabina adyuvante después
de la quimioterapia estándar en pacientes con CMTN temprano, pero este estudio no
pudo mostrar un aumento estadísticamente significativo de la SLE al añadir capecitabina
a la quimioterapia estándar en pacientes con CMTN temprano [14].
Teniendo en cuenta los resultados contradictorios y, además, la ausencia de datos
provenientes de poblaciones latinoamericanas sobre el efecto de la capecitabina neoadyuvante
en pacientes con CMTN, se hace necesario aportar nueva evidencia que permita sacar
conclusiones e individualizar opciones de tratamiento para estas pacientes.
El objetivo primario de este estudio fue evaluar la supervivencia libre de progresión
(SLP) de pacientes con cáncer de mama triple negativo estadio I-III con enfermedad
residual postneoadyuvancia, tratadas con capecitabina, en un centro de referencia
oncológico de la ciudad de Medellín, Colombia. Como objetivo secundario se evaluó
la SG en estas pacientes.
2. Materiales y métodos
El protocolo de este estudio fue aprobado por el Comité institucional de Ética de
la Investigación en seres Humanos de la Universidad CES (cod Acta211Proy973) y de
la Fundación Colombiana de Cancerología Clínica Vida (FCCCV). Es un estudio retrospectivo,
sin intervención alguna en la atención de las pacientes, por lo que no se requirió
de consentimiento informado para estudios de investigación de la institución. Se garantizó
el anonimato y la confidencialidad de los datos de las pacientes. El reporte de resultados
sigue las recomendaciones de la guía STROBE [15].
2.1 Diseño y contexto
Estudio observacional de seguimiento a una cohorte desde el 15 de abril del 2018 hasta
el 27 de abril del 2023, hasta la muerte o censura administrativa, según los registros
tomados de la base de datos de la FCCCV de Medellín, entre el 2019 y el 2023. La recolección
de los datos se realizó desde el 15 de febrero del 2023 hasta el 18 de mayo del 2023.
El 6 de junio del 2023 se evaluó para todas las pacientes la mortalidad en la plataforma
de la Administradora de los Recursos del Sistema General de Seguridad Social en Salud
(Adres) [16]. Adres es la entidad del Estado en la cual se encuentran los registros de la población,
incluida su fecha de fallecimiento.
2.2 Participantes
De la información suministrada por la institución FCCCV, en total se revisaron 144
historias de pacientes a quienes se les prescribió capecitabina en la institución.
Las pacientes fueron incluidas en el estudio si cumplían con los siguientes criterios:
mujeres mayores de 18 años, con cáncer de mama triple negativo, estadio I-III, con
enfermedad residual tras quimioterapia neoadyuvante y que recibieron capecitabina
como monoterapia adyuvante. Los criterios de exclusión fueron tener cáncer de mama
bilateral, cánceres múltiples sincrónicos, tratamiento previo con fluoracilo oral,
pacientes embarazadas y en periodo de lactancia. También se excluyeron las pacientes
cuyos registros tenían más del 10 % de los datos perdidos.
2.3 Cáncer de mama triple negativo
El subtipo triple negativo fue definido como la negatividad en los receptores hormonales
por inmunohistoquímica y Her2 negativo por inmunohistoquímica (Her2 0 o 1+) o prueba
FISH (hibridación in situ) en los casos de Her2 equívoco (2+).
2.4 Variables
La variable de resultado principal fue la SG, que se calculó desde el momento del
inicio del tratamiento hasta el último seguimiento o el momento de la muerte por cualquier
causa. La SLP fue una variable resultado secundaria que se calculó desde el momento
del inicio del tratamiento hasta que se documentó la progresión o al último control
sin evidencia de progresión. Se tomaron en cuenta las características iniciales de
las pacientes: edad, estado menopaúsico, tamaño tumoral, afectación ganglionar axilar,
esquema de quimioterapia neoadyuvante recibido, cirugía realizada, así como también
características de la enfermedad residual, enfocada en la carga tumoral residual (RCB,
Residual Cancer Burden).
2.5 Fuentes de datos
Se solicitó al equipo de informática de la FCCCV la lista de pacientes ingresadas
entre el 2019 y el 2023 por CMTN, tratadas con capecitabina adyuvante, posteriormente
se realizó la revisión del historial médico de cada una de ellas para determinar quiénes
cumplían con los criterios de inclusión y así obtener los datos de interés para el
estudio.
Para determinar el diagnóstico, se tomó la fecha del primer estudio histopatológico.
Para la progresión se registró la fecha del primer estudio imagenológico que evidenció
el cambio locorregional o a distancia. Finalmente, la fecha de corte para evaluar
la sobrevida fue el 6 de junio del 2023 para todas las pacientes; se comprobó el estado
de la actividad en la plataforma Adres [16].
2.6 Control de sesgos
La recolección de datos la realizó un investigador verificando en cada una de las
historias que se cumpliera con los requisitos de inclusión y consignándolos en la
correspondiente plantilla de Excel, en la que se estipulaba cada variable de interés.
En caso de dudas en algún registro de variables, se consultó con los investigadores
expertos en el área (mastólogo, oncólogo o epidemióloga). Se revisó la historia clínica,
si carecía de información o estaba incompleta, se verificaban las evaluaciones de
mastología, y cuando no se contaba con ninguna, los datos eran extraídos de las notas
de las otras especialidades relacionadas con el cuidado de la paciente por su condición
oncológica (dolor y cuidado paliativo o rehabilitación oncológica).
2.7 Métodos estadísticos
Se realizó un análisis univariado con el fin de caracterizar la población de estudio.
Se tuvo en cuenta la naturaleza de las variables, para el caso de las variables cuantitativas
se realizó la prueba de normalidad de Kolmogorov-Smirnov, para definir si estas variables
se presentan con promedios o medianas. Las variables cualitativas se presentaron usando
frecuencias absolutas y relativas. La mediana de la supervivencia se calculó mediante
la curva de Kaplan Meier.
Para el análisis bivariado las diferencias en la supervivencia según covariables se
calcularon con la prueba de log Rank test.
Se realizó un análisis multivariado a través de la asociación entre covariables y
el tiempo al evento mediante una regresión de COX. Un valor de p inferior a 0,05 se
consideró estadísticamente significativo. Todos los análisis se realizaron en el programa
SPSS versión 25.
3. Resultados
3.1 Participantes
Un total de 41 pacientes cumplieron con los criterios de inclusión: una mediana de
edad de 55 (44,5-65,5) años; 25 de ellas (61 %) eran posmenopáusicas, solo 16 (39
%) eran premenopáusicas. El subtipo histológico más frecuente fue el carcinoma ductal
invasor en 39 de ellas (95,1%). El T4b fue la estadificación más frecuente de las
pacientes en 14 de ellas (36,6 %). Los datos descriptivos iniciales de las pacientes
se presentan en la Tabla 1.
Tabla 1
Características iniciales de las pacientes con cáncer de mama triple negativo con
enfermedad residual postneoadyuvancia
|
Características
|
N (%)
|
|
Edad
|
|
|
Mediana (rango intercuartílico)
|
55(44,5-65,5)
|
|
Estado menopaúsico
|
|
|
Premenopáusicas
|
16 (39)
|
|
postmenopáusicas
|
25 (61)
|
|
Histología del tumor
|
|
|
Ductal
|
39 (95,1)
|
|
Lobular
|
1 (2,4)
|
|
Otro
|
1 (2,4)
|
|
Tamaño tumoral al diagnóstico
|
|
|
≤ 2cm
|
2 (4,8)
|
|
2,1-5 cm
|
16 (39)
|
|
≥5,1 cm
|
23 (56,1)
|
|
T previo
|
|
|
T2
|
11 (26,8)
|
|
T3
|
14 (34,1)
|
|
T4b
|
15 (36,6)
|
|
T4c
|
1 (2,4)
|
|
Grado histológico
|
|
|
1
|
1 (2,4)
|
|
2
|
10 (24,4)
|
|
3
|
30 (76,2)
|
|
Ki67, Mediana (rango intercuartílico)
|
60 (40-80)
|
|
Focalidad
|
|
|
Unifocal
|
38 (92,7)
|
|
Multifocal
|
2 (4,9)
|
|
Multicéntrico
|
1 (2,4)
|
|
Afectación ganglionar
|
|
|
No
|
9 (31)
|
|
Sí
|
32 (78)
|
|
Neoadyuvancia recibida
|
|
|
Antraciclicas + Taxanos
|
36 (87,8)
|
|
Taxanos
|
1 (2,4)
|
|
Docetaxel + ciclofosfamida
|
1 (2,4)
|
|
Taxanos y platino
|
3 (7,3)
|
|
Cirugía realizada en mama
|
|
|
Cirugía conservadora
|
13 (31,7)
|
|
Mastectomía
|
28 (68,2)
|
|
Cirugía axilar realizada
|
|
|
BGC
|
7 (17,1)
|
|
BGC + VA
|
1 (2,1)
|
|
VA
|
27 (65,9)
|
|
Sin cirugía axilar
|
6 (14,6)
|
|
Radioterapia adyuvante
|
40 (97,6)
|
3.2 Respuesta a quimioterapia neoadyuvante y capecitabine
En el 70 % de los casos, el manejo con quimioterapia consistía en el uso de doxorrubicina
(60 mg/m2) más ciclofosfamida (600 mg/m2), cada 21 días con soporte de factores estimulantes de colonias granulocíticas en
cada ciclo, seguido de paclitaxel (80 mg/m2) semanal por 12 semanas. Tan solo el 22 % recibió esquema con antraciclinas en dosis
densa (cada 14 días) debido a barreras en el acceso. El uso de platinos en neoadyuvancia
se realizó en el 68 % de los casos en concomitancia con paclitaxel.
El esquema de quimioterapia neoadyuvante más común fue antraciclicas más taxanos en
36 pacientes (87,8 %), el otro esquema que se utilizó en tres pacientes (7,3 %) fue
el de taxanos más platinos, como se describe en la Tabla 1.
En ocho pacientes (19,5 %) la patología del espécimen quirúrgico reportó RCB 1, en
20 pacientes (48,8 %) RCB 2, y solo en 13 (31,7 %) fue reportado RCB 3. En la Tabla 2 se describen las características de las pacientes luego de la neoadyuvancia.
Tabla 2
Respuesta a quimioterapia neoadyuvante en pacientes con cáncer de mama triple negativo
con enfermedad residual posneoadyuvancia
|
Características
|
N (%)
|
|
RCB
|
|
|
1
|
8 (19,5)
|
|
2
|
20 (48,8)
|
|
3
|
13 (31,7)
|
|
Tamaño tumoral residual (mm)
|
|
|
Mediana (rango intercuartílico)
|
23 (10-36)
|
|
ypT
|
|
|
ypT0
|
1 (2,4)
|
|
ypT1a-ypT4c
|
40 (97,6)
|
|
Ganglios positivos
|
|
|
0
|
23 (56,1)
|
|
1-3
|
12 (29,3)
|
|
≥ 4
|
6 (16,6)
|
|
Tamaño de metástasis ganglionar (mm), mediana (RIQ)
|
2,63 (0-3)
|
|
Tamaño del lecho tumoral (mm), mediana (RIQ)
|
23 (11,50-38,50)
|
|
Celularidad postneoadyuvancia (%), mediana (RIQ)
|
50 (12,50-65)
|
|
CDIS residual (%), mediana (RIQ)
|
1 (0-20)
|
|
Progresión
|
|
|
No
|
30 (76,2)
|
|
Sí
|
11 (26,8)
|
|
Sitio de progresión
|
|
|
Regional
|
2 (18,1)
|
|
Loco-regional
|
2 (18,1)
|
|
Distancia
|
7 (63,6)
|
|
Sitio de progresión a distancia
|
|
|
SNC
|
1 (2,4)
|
|
Pulmones
|
2 (4,9)
|
|
Ganglionar
|
2 (4,9)
|
|
Huesos
|
2 (4,9)
|
|
Muerte
|
|
|
No
|
37 (90,2)
|
|
Sí
|
4 (9,8)
|
3.3 Supervivencia libre de progresión
La mediana de SLP fue de 25,03 meses (IC 95 %, 13,37-36,68). Once pacientes (26,8
%) presentaron progresión de la enfermedad tras iniciar el tratamiento adyuvante con
capecitabina (Figura 1). Entre el total de pacientes en quienes se documentó progresión, en siete pacientes
(63,6 %) se documentó progresión a distancia; en dos (18,1%), progresión regional
y en otras dos (18,1%), progresión loco-regional, como se describe en la Tabla 2. La progresión a distancia más frecuente fue la ganglionar en dos pacientes (2,9
%), seguida de metástasis a pulmón y huesos, ambos grupos con la misma representación
de dos pacientes (4,9 %). Entre las pacientes con progresión, cuatro murieron por
esta causa. Al realizar el análisis multivariado (Tabla 3), las características que se asociaron de forma estadísticamente significativa en
pacientes que recibieron adyuvancia con capecitabina fueron el estado posmenopáusico
como factor protector para progresión (HR 0,32, IC del 95 % 0,09 -0,98, p 0,045) y
un tamaño tumoral previo superior presentó mayor riesgo de progresión de la enfermedad
en el tiempo (HR 1,69, IC del 95 %, 1,02-2,81, p = 0,041).
Figura 1
Supervivencia libre de progresión (SLP) en pacientes con cáncer de mama triple negativo
con enfermedad residual postneoadyuvancia que recibieron capecitabina adyuvante.
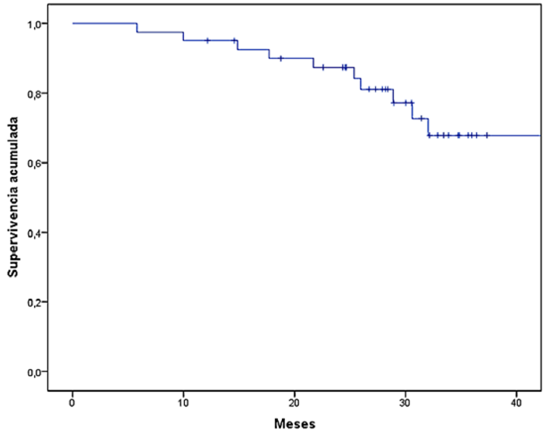
Tabla 3
Factores asociados al tiempo de la progresión en pacientes tratadas con capecitabina
|
Variable
|
Univariado
|
Multivariado
|
|
HR 95 %(CI)
|
valor de p
|
HR 95 %(CI)
|
valor de p
|
|
Edad
|
0,97 (0,93-1,01)
|
0,162
|
|
|
|
Menopausia
|
0,32 (0,09-0,98)
|
0,045
|
|
|
|
Ki67
|
0,98 (0,95-1,01)
|
0,347
|
|
|
|
T previo
|
1,69 (1,02-2,81)
|
0,041
|
1,69 (1,02-2,81)
|
0,041
|
|
Afectación ganglionar previa
|
3,02 (0,38-23,94)
|
0,294
|
|
|
|
Cirugía en mama (mastectomía/conservadora)
|
0,77 (0,23-2,56)
|
0,681
|
|
|
|
Ganglios afectados
|
|
|
|
|
|
0
|
ref
|
0,039
|
|
|
|
1 a 3
|
1,63 (0,36-7,38
|
|
|
|
4
|
3,85 (1,10-13,39)
|
|
|
|
Tamaño del ganglio mayor
|
1,04 (0,98-1,12)
|
0,158
|
|
|
|
RCB
|
|
|
|
|
|
1
|
ref
|
0,208
|
|
|
|
2
|
0,47 (0,06-3,42)
|
|
|
|
3
|
1.95 (0,39-9,72)
|
|
|
|
Focalidad
|
|
|
|
|
|
Multifocal o multicéntrico/unifocal
|
0.04 (0.01-9.70)
|
0,854
|
|
|
|
NACT
|
|
|
|
|
|
(Taxanos + platino /Antraciclinas + taxanos)
|
2.76 (0.71-10.61)
|
0.139
|
|
|
|
YpT (ypT1a-ypT4c/Yp0)
|
2,13 (0,62-7,28)
|
0,228
|
|
|
3.4 Supervivencia global
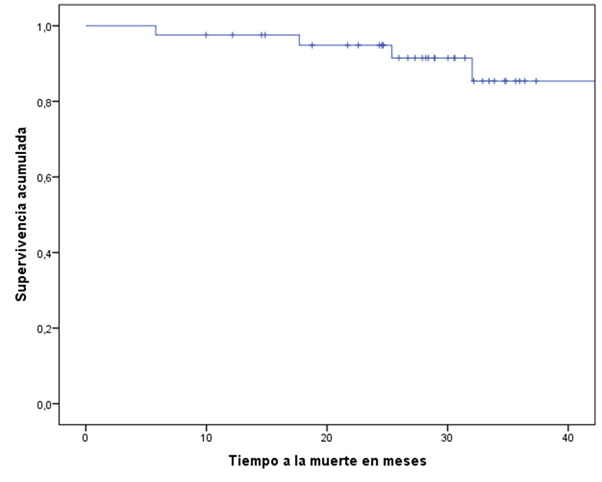
La media de SG fue de 50,37 meses (IC 95 %, 45,3-55,5). Al realizar el análisis de
supervivencia por RCB, se encuentra que la media de SG fue de 51, 50 y 46 meses para
RCB 1, RCB 2 y RCB 3 respectivamente (Figura 2), y esta diferencia no fue estadísticamente significativa (p = 0,614). Tampoco hubo
diferencias significativas según los diferentes esquemas neoadyuvante o el tipo de
cirugía que se realizó.
Figura 2
Supervivencia global (SG) en pacientes con cáncer de mama triple negativo con enfermedad
residual postneoadyuvancia que recibieron capecitabina adyuvante.
4. Discusión
En Colombia no se cuenta con una caracterización clara, retrospectiva o prospectiva,
de estas pacientes con enfermedad residual postneoadyuvancia que evalúe el posible
efecto de la capecitabina en la SG de las personas afectadas; por lo tanto, este protocolo
planteó evaluar de forma objetiva y retrospectiva las características de este grupo
de pacientes y su comportamiento frente a la SLP y la SG. Se analizaron 41 pacientes,
de las cuales, el 26 % presentó progresión de la enfermedad a los 36 meses y, de estas,
cuatro pacientes murieron por esta causa.
Las pacientes de este estudio tenían una mediana de edad de 55 años (RIQ 44,5-65,6),
similar al estudio Create X, 48 años (rango 25-74 años) (13), y de 49 años (rango 20-82 años) de las pacientes del GEICAM/2003-11_CIBOMA/2004-01
[14]. Al comparar los resultados de este estudio con los estudios mencionados, se observa
que la SG en ellos fue del 94 % a cinco años en el grupo que recibió capecitabina
[13], resultado mayor al compararlo con este estudio, con una SG de 80,6 % a los tres
años. En el estudio GEICAM/2003-11_CIBOMA/2004-01 la SG de cinco años en el grupo
de capecitabina fue de 86,2 % [13]; esto indica que aun así estos resultados son inferiores, por tanto, en futuros
estudios prospectivos en nuestra población será necesario evaluar cuáles son las características
desfavorables que están presentes. Una de esas características podría ser que en este
estudio el 35,5 % eran tumores que afectaban piel o pared torácica; en la población
del estudio Create X este grupo de pacientes solo era el 11,7 %, y en el estudio GEICAM/2003-11
CIBOMA/2004-01 no se especifica esa característica. En cuanto al tamaño tumoral, el
56,1 % tenía tumores mayores a 5 cm, mientras en el Create X solo el 15,1 % tenía
tumores de este tamaño. Además, cabe señalar que el factor del tamaño tumoral al debut
fue el único factor pronóstico independiente relacionado con la SLE en el análisis
multivariado, lo cual indica que la cohorte en este estudio representa un grupo de
pacientes con características iniciales más agresivas y, por consiguiente, su pronóstico
sería menos favorable a pesar del uso de capecitabina adyuvante.
En este estudio, el 54,5 % de las pacientes que presentaron progresión eran premenopáusicas.
Esta variable no fue evaluada en el Create X, en el grupo del GEICAM/2003-11 CIBOMA/2004-01
no hubo diferencias significativas entre estos dos grupos: premenopáusicas HR 0,686
(IC del 95 %, 0,408-1,153) frente a las postmenopáusicas HR 0,867 (IC del 95 %, 0,639-1,176).
Uno de los enfoques del estudio era evaluar el impacto del RCB en cuanto al pronóstico;
sin embargo, no se encontraron diferencias estadísticamente significativas ni en SLP
ni en SG entre los grupos RCB 1, RCB 2 y RCB 3, ya que al realizar el análisis de
supervivencia por RCB se encontró que la media de supervivencia fue de 51, 50 y 46
meses para RCB 1, RCB 2 y RCB 3 respectivamente, y esto no fue estadísticamente significativo:
p 0,614. Los estudios Create X y GEICAM/2003-11_CIBOMA/2004-01 no evaluaron estas
variables.
En el metaanálisis realizado por Ye F et al. [17], se evaluó la eficacia de la capecitabina como quimioterapia adyuvante para el CMTN
en fase inicial, tratado con quimioterapia basada en taxanos/antraciclinas y encontraron
un aumento significativo de la SLE con la adición de capecitabina (cociente de riesgos
[HR] = 0,77, IC del 95 %: 0,66-0,90). En los ensayos que incluían de seis a ocho ciclos
de adición de capecitabina, se observó una mejora significativa de la SLE. Además,
en un metaanálisis de seis ensayos, se detectó un aumento significativo de la SG en
el grupo de capecitabina (HR = 0,69, IC del 95 %: 0,56-0,85) [17].
En el tratamiento neoadyuvante del CMTN, las antraciclinas, como la doxorrubicina
y la epirrubicina, se utilizan en dosis densas en combinación con ciclofosfamida.
Este enfoque, conocido como quimioterapia de dosis densa, implica administrar las
antraciclinas en intervalos más cortos de lo habitual, generalmente cada dos semanas
en lugar de cada tres semanas. La quimioterapia en dosis densa ha demostrado mejorar
las tasas de respuesta patológica completa, aumenta la SLE y la SG en comparación
con la quimioterapia estándar en algunos estudios [18-22]. Sin embargo, en este estudio tan solo el 22 % de los pacientes recibieron este
esquema debido a barreras en el acceso. Adicionalmente, la quimioterapia en dosis
densa también puede estar asociada con un mayor riesgo de efectos secundarios como
neutropenia febril, lo cual obliga a realizar soporte con factores de colonias granulocíticas
para reducir este riesgo de complicaciones [18-21].
El uso de inmunoterapia, y en especial con pembrolizumab, se ha explorado en el manejo
neo y adyuvante en cáncer de mama triple negativo [23]. El estudio KEYNOTE-522 evaluó la seguridad y la eficacia de pembrolizumab en combinación
con quimioterapia neoadyuvante seguida de pembrolizumab como terapia adyuvante en
pacientes con CMTN en estadio temprano [24-25]. El estudio incluyó 1174 pacientes sin tratamiento previo con CMTN en estadios II
o III y fueron asignados aleatoriamente a recibir quimioterapia neoadyuvante con carboplatino/paclitaxel
y antraciclinas con o sin pembrolizumab. Después de la cirugía, los pacientes recibieron
pembrolizumab o placebo como terapia adyuvante complementaria durante un año. El estudio
mostró que la adición de pembrolizumab a quimioterapia neoadyuvante aumentó la tasa
total de pCR del 51 al 65 % independiente de la expresión de PD-L1 [24-25].
En el seguimiento, la adición de pembrolizumab mejoró la SLE a 36 meses (85 % con
pembrolizumab versus 77 % con placebo), con una reducción del 37 % en los eventos
(HR 0,63, CI del 95 % 0,48-0,82) [25]. La SLE con la adición de pembrolizumab tuvo un mayor beneficio absoluto en los
pacientes que no lograron el pCR con quimioterapia neoadyuvante (NACT) que en los
pacientes que lograron el pCR (94 versus 92 %), lo cual plantea la necesidad de tratamiento
complementario adyuvante adicional en pacientes con enfermedad residual postneoadyuvancia
en la que capecitabina puede potencialmente combinarse con pembrolizumab en este subgrupo.
Sin embargo, el estudio no contempló la adición de capecitabina en estos casos y falta
aún esperar resultados maduros de este estudio a largo plazo en este aspecto. En Colombia,
el tratamiento con inmunoterapia (pembrolizumab) no está disponible para uso en esta
indicación.
Este estudio fue de tipo observacional, con las limitaciones inherentes a este tipo
de diseño. Los resultados de este estudio permitieron hacer una comparación con las
publicaciones internacionales acerca de las características poblacionales y del beneficio
del tratamiento con capecitabina en este grupo de pacientes. Sin embargo, se encontró
que, en este grupo de pacientes, en las cuales se analizaron la SG y SLP, fueron similares
a estudios internacionales. Como una de las limitaciones importantes fue el no tener
un grupo control al cual no se le indicara capecitabina como quimioterapia neoadyuvante.
5. Conclusiones
Con capecitabina adyuvante en pacientes con cáncer de mama triple negativo con enfermedad
residual postneoadyuvancia se observaron resultados favorables, particularmente, en
aquellas pacientes postmenopáusicas y con menor tamaño tumoral previo, independiente
del RCB, ya que estas presentaron mejor SLP y SG. Se necesitan estudios que comparen
a las pacientes que recibieron capecitabina adyuvante con otras que no hayan recibido
otro esquema.