1. Introduction
It is estimated that 3-8% of patients diagnosed with breast cancer may be diagnosed
with metastatic disease [1]. The standard treatment for these cases is systemic therapy with significantly improved
OS and PFS, especially in patients with positive hormone receptors and/or HER2 [2,3].
Surgery has been conceived as a therapeutic approach aimed at relieving symptoms and
preventing complications associated with the local progression of the disease [3]. However, it has also been suggested that it has a beneficial effect in prolonging
patient OS through various mechanisms such as reduction of tumor load, elimination
of cancer stem cells, reversal of tumor-induced immunosuppression, reduction in clonal
heterogeneity, discontinuation of primary tumor self-seeding, interruption of multidirectional
tumor cell movement between primary and distant tumor sites, and decrease in tumor
promoter activities mediated by cancer stem cells [4].
As a result, the combined use of systemic therapy and surgical management in patients
with stage IV breast cancer has been investigated. RCTs report contradictory results
in terms of OS for those receiving both therapies [3,5-7], while retrospective studies, resulting from real-life experiences, show an improvement
in this parameter [3,8-12]. It provides relevant evidence in therapeutic decision-making.
Our research aims to describe the OS and PFS of patients with early-stage IV breast
cancer, who received CT and EST at a specialized cancer care center in Medellín -
Colombia.
2. Methods
An observational retrospective cohort study was carried out using information from
Fundación Colombiana de Cancerología Clínica Vida (FCCCV) database in Medellín, between
2013 and 2021. Data collection was carried out from 1 October 2022 to 15 January 2023.
Data of individuals who met the inclusion criteria were recorded, so the sample corresponded
to the total number of patients.
2.1. Patients
The inclusion criteria were: 1) Patients over 18 years of age with infiltrating stage
IV breast cancer at diagnosis; 2) Histological confirmation of primary disease; 3)
Clinical or imaging confirmation for metastatic disease; 4) Management with systemic
therapy only and/or local or regional surgery, considering any type of breast or axillary
surgery. 270 patients met the criteria and were reviewed. Exclusion criteria were
considered as follows: medical histories with more than 10% of the data lost, stage
IV disease by progression, pregnancy, lactation, metachronous breast cancer, and breast
cancer as second primary.
2.2. Variables
The primary result was OS calculated from the start of treatment to the last follow-up
or death from any cause. PFS was a secondary outcome calculated from the start of
treatment to the date of last follow-up or at which progress was documented.
Variables were evaluated in two groups of patients: exclusive systemic therapy and
combined therapy (systemic treatment plus breast and/or axillary surgery). Characteristics
of individuals at the time of diagnosis were collected in both groups: age, menopausal
status, and body mass index (BMI). The characteristics of the tumor were also recorded:
histological type and grade molecular subtype, tumor size, clinical and pathological
classification of regional nodules according to TNM classification [13], site and number of metastases, date, and site of first progression.
The date of diagnosis was the one described in the first study that documented the
disease remotely; if this information was not available, the date of the biopsy report;
and, if none of the previous were available, the data provided in the institution's
database. The date of progression of the disease for the first study was recorded.
Finally, the cutoff date for assessing the OS was 8 January 2023 via the Adres platform
(www.adres.gov.co/consulte-su-ep).
2.3. Statistical methods
A univariate analysis was carried out to characterize the study population. In the
case of quantitative variables, the Kolmogorov-Smirnov normality test was applied
to determine whether they presented averages or medians. Qualitative variables were
determined using absolute and relative frequencies. Median survival was calculated
using the Kaplan Meier curve.
For bivariate analysis, survival associations with each factor were calculated independently;
for qualitative variables, chi square of independence; for quantitative variables,
student’s t-test or Mann-Whitney U test (quantitative - qualitative). The differences
in covariable survival were calculated using the Logrank test.
A multivariate analysis was performed to measure the association between covariables
and the event occurrence time using a Cox regression. A p value less than 0.05 was
considered statistically significant.
As a sensitivity analysis of the possible effect of confounding by indication, a Propensity
Score analysis was performed using a logistic regression model, estimating the expected
effect throughout the sample. The probability difference is presented with its respective
confidence interval.
All analyses were carried out by the STATA software version 16.1.
3. Results
A total of 270 patients met the inclusion criteria, eight cases with unknown start
date were excluded, thus obtaining a final group of 262 patients: 174 receiving EST,
and 88 receiving CT.
Table 1
Demographic characteristics
|
Characteristic
|
Systemic treatment (N = 174)
|
Systemic + surgical treatment (N = 88)
|
P
|
|
Age, average ± Standard deviation
|
56.6 (13,4)
|
56.3 (14)
|
0.17
|
|
Menopausal status
|
|
|
|
|
Premenopausal
|
48 (27.6)
|
26 (29.5)
|
0.77
|
|
Postmenopausal
|
122 (70.1)
|
61 (69.3)
|
|
|
Unknown
|
4 (2.3)
|
1 (1.1)
|
|
|
Body mass index
|
|
|
|
|
Low weight:<18.5
|
18 (10.3)
|
6 (6.8)
|
0.19
|
|
Normal: 18.5 - 24.9
|
74 (42.5)
|
27 (30.7)
|
|
|
Overweight25 - 29.9
|
45 (25.9)
|
29 (33)
|
|
|
Obesity: > 30
|
17 (9.8)
|
14 (15.9)
|
|
|
Unknown
|
20 (11.5)
|
12 (13.6)
|
|
Characteristics of the disease are presented in Table 2. CT patients showed significantly more oligometastases and inflammatory tumors, while
EST patients had significantly higher bone, pleural, liver metastases, and T4b tumors.
The other characteristics were balanced.
Table 2
Characteristics of the disease
|
Characteristics
|
Systemic treatment (N = 174)
|
Systemic + surgical treatment (N = 88)
|
P
|
|
Laterality
|
|
|
|
|
Unilateral
|
165 (94.8)
|
83 (94.3)
|
0.53
|
|
Bilateral
|
9 (5.2)
|
5 (5.7)
|
|
Histological type
|
|
|
|
|
Infiltrating ductal carcinoma
|
144 (82.8)
|
81 (92)
|
0.26
|
|
Infiltrating lobular carcinoma
|
13 (7.5)
|
5 (5.7)
|
|
|
Mixed
|
2 (1.1)
|
0
|
|
|
Other
|
5 (2.9)
|
0
|
|
|
Occult carcinoma
|
3 (1.7)
|
0
|
|
|
Unknown
|
7 (4)
|
2 (2.3)
|
|
|
Histological grade
|
|
|
|
|
1
|
17 (9.8)
|
8 (9.1)
|
0.15
|
|
2
|
73 (42)
|
32 (36.4)
|
|
|
3
|
65 (37.4)
|
35 (39.8)
|
|
|
Occult carcinoma
|
6 (3.4)
|
0
|
|
|
Unknown
|
13 (7.5)
|
13 (14.8)
|
|
|
ER status
|
|
|
|
|
Positive
|
131 (75.3)
|
60 (68.2)
|
0.45
|
|
Negative
|
42 (24.1)
|
27 (30.7)
|
|
|
Unknown
|
1 (0.6)
|
1 (1.1)
|
|
|
PR status
|
|
|
|
|
Positive
|
108 (62.1)
|
50 (56.8)
|
0.7
|
|
Negative
|
64 (36.8)
|
37 (42)
|
|
|
Unknown
|
2 (1.1)
|
1 (1.1)
|
|
|
Her 2 status
|
|
|
|
|
Positive
|
34 (19.5)
|
19 (21.6)
|
0.82
|
|
Negative
|
138 (79.3)
|
68 (77.3)
|
|
|
Equivocal, not FISH
|
1 (0.6)
|
0
|
|
|
Unknown
|
1 (0.6)
|
1 (1.1)
|
|
|
Ki 67, median + IQR
|
36.4 + 22
|
38.7 + 25.3
|
0.70
|
|
Subtype IHC
|
|
|
|
|
Luminal A
|
30 (17.2)
|
15 (17)
|
0.16
|
|
Luminal B
|
85 (48.9)
|
31 (35.2)
|
|
|
Triple negative
|
25 (14.4)
|
20 (22.7)
|
|
|
Luminal-HER2
|
18 (10.3)
|
13 (14.8)
|
|
|
HER2 positive
|
16 (9.2)
|
8 (9.1)
|
|
|
Unknown
|
0
|
1 (1.1)
|
|
|
Number of metastases
|
|
|
|
|
<4
|
18 (10.3)
|
32 (36.4)
|
<0.001
|
|
>4
|
155 (89.1)
|
54 (61.4)
|
|
|
Unknown
|
1 (0.6)
|
2 (2.3)
|
|
|
Metastatic site
|
|
|
|
|
Bone
|
123 (70.7)
|
51 (58)
|
0.02
|
|
No
|
51 (29.3)
|
37 (42)
|
|
|
Lung
|
59 (33.9)
|
27 (30.7)
|
0.35
|
|
No
|
115 (66.1)
|
61 (69.3)
|
|
|
Liver
|
39 (22.4)
|
6 (6.8)
|
0.001
|
|
No
|
135 (77.6)
|
82 (93.2)
|
|
|
NCS
|
6 (3.4)
|
2 (2.3)
|
0.46
|
|
No
|
168 (96.6)
|
86 (97.7)
|
|
|
Distance
|
49 (28.2)
|
22 (25)
|
0.34
|
|
No
|
125 (71.8)
|
66 (75)
|
|
|
Pleural
|
19 (10.9)
|
4 (4.5)
|
0.06
|
|
No
|
155 (89.1)
|
84 (95.5)
|
|
|
Other
|
19 (10.9)
|
3 (13.6)
|
0.02
|
|
No
|
155 (89.1)
|
865 (96.6)
|
|
|
Tumor size
|
|
|
|
|
T1
|
4 (2.3)
|
2 (2.3)
|
0.02
|
|
T2
|
32 (18.4)
|
14 (15.9)
|
|
|
T3
|
19 (10.9)
|
13 (14.8)
|
|
|
T4a
|
2 (1.1)
|
5 (5.7)
|
|
|
T4b
|
80 (46)
|
34 (38.6)
|
|
|
T4C
|
5 (2.9)
|
3 (3.4)
|
|
|
T4d
|
17 (9.8)
|
17 (19.3)
|
|
|
TX
|
9 (5.2)
|
0
|
|
|
Unknown
|
6 (3.4)
|
0
|
|
|
Focality
|
|
|
|
|
Unifocal
|
157 (90.2)
|
81 (92)
|
0.17
|
|
Multifocal
|
7 (4)
|
3 (3.4)
|
|
|
Multicentric
|
3 (1.7)
|
2 (2.3)
|
|
|
Multifocal and multicentric
|
0
|
2 (2.3)
|
|
|
Occult
|
5 (2.9)
|
0
|
|
|
Unknown
|
2 (1.1)
|
0
|
|
|
Clinical N
|
|
|
|
|
N1
|
58 (33.3)
|
29 (33.3)
|
0.16
|
|
N2
|
58 (33.3)
|
28 (31.8)
|
|
|
N3
|
29 (16.7)
|
24 (27.3)
|
|
|
N0
|
14 (8)
|
6 (6.8)
|
|
|
Nx
|
8 (4.6)
|
0
|
|
|
Unknown
|
7 (4.1)
|
1 (1.1)
|
|
When evaluating the treatment characteristics, significant differences between groups
were found in almost all the variables. Thus, CT patients presented significantly
higher requirements for cytotoxic therapy, polychemotherapy, and the use of Anthracycline
drugs with taxans. While patients with EST received significantly more endocrine therapy
with aromatase inhibitors (AI) and the combination of AI with cyclin-dependent kinase
inhibitor (CDKI). Radiation therapy was administered significantly more in the CT
group. There were no differences between the groups regarding the use of anti-Her
therapy and suppression of ovarian function. (Table 3).
Characteristics of surgical treatment are presented in Table 4.
Table 3
Characteristics of the treatment
|
Characteristics
|
Systemic treatment (N = 174)
|
Systemic + surgical treatment (N = 88)
|
P
|
|
Cytotoxic therapy
|
|
|
|
|
Monochemotherapy
|
61 (35.1)
|
20 (22.7)
|
0.002
|
|
Polychemotherapy
|
70 (40.2)
|
56 (63.6)
|
|
|
No CT/do not accept
|
43 (24.7)
|
12 (13.6)
|
|
|
Chemotherapy drug
|
|
|
|
|
Taxans
|
53 (30.5)
|
13 (14.8)
|
0.001
|
|
Anthracyclines
|
14 (8)
|
2 (2.3)
|
|
|
Platinum
|
0
|
1 (1.1)
|
|
|
Capecitabine
|
1 (0.6)
|
1 (1.1)
|
|
|
Taxans and platinum
|
10 (5.7)
|
7 (8)
|
|
|
Taxans y Anthracyclines
|
38 (21.8)
|
40 (45.5)
|
|
|
Taxans and others
|
6 (3.4)
|
3 (3.4)
|
|
|
Antracyclic and others
|
2 (1.1)
|
1 (1.1)
|
|
|
Platinum and others
|
1 (0.6)
|
0
|
|
|
Taxans, anthracyclines and platinum
|
3 (1.7)
|
3 (3.4)
|
|
|
Others
|
3 (1.7)
|
6 (6.8)
|
|
|
Do not require
|
43 (24.7)
|
11 (12.5)
|
|
|
Endocrine Therapy
|
|
|
|
|
Tamoxifen
|
16 (9.2)
|
17 (19.3)
|
0.01
|
|
Aromatase inhibitor
|
60 (34.5)
|
26 (29.5)
|
|
|
Fulvestrant
|
4 (2.3)
|
5 (5.7)
|
|
|
Cycline and aromatase inhibitor
|
37 (21.3)
|
6 (6.8)
|
|
|
Cycline and fulvestrant inhibitor
|
2 (1.1)
|
0
|
|
|
Fulvestran anastrozole
|
1 (0.6)
|
0
|
|
|
Do not receive
|
11 (6.3)
|
4 (4.5)
|
|
|
Do not require
|
43 (24.7)
|
30 (34.1)
|
|
|
Suppression of ovarian function
|
|
|
|
|
Surgical
|
19 (10.9)
|
7 (8)
|
0.47
|
|
Medicine
|
6 (3.4)
|
6 (6.8)
|
|
|
Radiotherapy
|
3 (1.7)
|
3 (3.4)
|
|
|
Do not receive
|
8 (4.6)
|
2 (2.3)
|
|
|
Do not require
|
138 (79.3)
|
70 (79.5)
|
|
|
Anti HER2 Therapy
|
|
|
|
|
Trastuzumab
|
10 (5.7)
|
10 (11.4)
|
0.4
|
|
Pertuzumab
|
2 (1.1)
|
0
|
|
|
Tratuzumab + Pertuzumab
|
25 (14.4)
|
12 (13.6)
|
|
|
Do not receive
|
1 (0.6)
|
0
|
|
|
Do not require
|
136 (78.2)
|
66 (75)
|
|
|
Locoregional radiotherapy
|
|
|
|
|
Breast
|
7 (4)
|
2 (2.3)
|
<0.001
|
|
Breast and locoregional nodules
|
5 (2.9)
|
6 (6.8)
|
|
|
Rib cage
|
0
|
8 (9.1)
|
|
|
Rib cage and y locoregional nodules
|
0
|
9 (10.2)
|
|
|
Axial
|
1 (0.6)
|
1 (1.1)
|
|
|
Do not receive
|
156 (89.7)
|
35 (39.8)
|
|
|
Unknown
|
5 (2.9)
|
27 (30.7)
|
|
|
Radiotherapy to metastasis
|
|
|
|
|
Yes
|
70 (40.2)
|
21 (23.9)
|
0.04
|
|
No
|
102 (58.6)
|
67 (76.1)
|
|
|
Unknown
|
2 (1.2)
|
0
|
|
Table 4
Surgical and systemic treatment characteristics
|
Characteristics
|
Systemic + surgical treatment (N = 88)
|
|
Average N positive by pathology
|
5.3 + 6.2
|
|
First management
|
|
|
Systemic
|
78 (88.6)
|
|
Surgical
|
10 (11.4)
|
|
Cause of surgery
|
|
|
Hygienic
|
24 (27.3)
|
|
Systemic but non-local response, albeit stable
|
21 (23.9)
|
|
Complete clinical response
|
11 (12.5)
|
|
No systemic or local response
|
1 (1.1)
|
|
Stable systemic disease and local progression
|
1 (1.1)
|
|
Others
|
10 (11.4)
|
|
Unknown
|
20 (22.7)
|
|
Type of Surgery
|
|
|
Modified radical mastectomy
|
71 (80.7)
|
|
Simple mastectomy
|
2 (2.3)
|
|
Conservative surgery and axillary dissection
|
10 (11.4)
|
|
Conservative surgery
|
1 (1.1)
|
|
Conservative surgery and sentinel ganglion biopsy
|
2 (2.3)
|
|
Axillary dissection
|
2 (2.2)
|
4. Survival analysis
The 262 patients provided a total of 6910.92 months of follow-up with an average of
58.38 months (range 48.6 - 68 months) and a median of 36.17 months (95% CI 26.91-45,42).
4.1. Progression-free survival
114 progression events occurred, 85 in the EST group and 29 in the CT group. The average
PFS in the EST group was 38.56 months (range 29.89-47.24); while for the CT group
it was 72.25 (rang 60.92.83.37), i.e., a statistically significant result (p<0.001)
(Figure 1A).
PFS at the year of diagnosis was 79.6% (95% CI 72.2-85.2%) and 90.2% (95 % CI 81.4-95%);
at 5 years of age 11.5% (4.6-21.8% CI 95%) and 54.6% (30.8-67.9%) for EST vs. CT,
respectively.
4.2. Overall survival
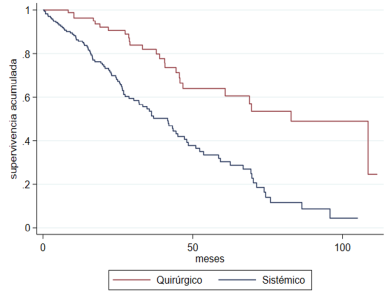
118 deaths occurred, 92 in the EST group and 26 in the CT group. The median OS for
the entire population was 48.63 months (95% CI 40.43-56.82): for the EST group, it
was 42.4 months (93% CI 95% 33, 23-51.56); and for the CT group, 82.33 (95 % CI 62.1-102.55),
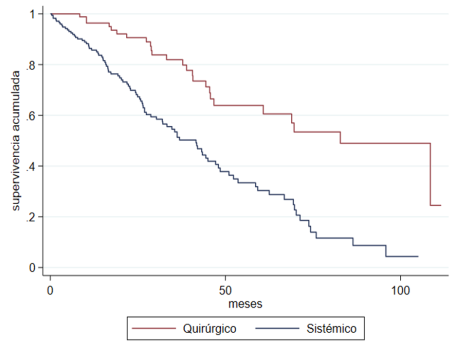
i.e., a statistically significant difference (p<0.001) (Figure 1B).
OS at the year of diagnosis was 85.7% (CI 95 %: 79.4-90,2%) and 96.4% (CI 95%: 89.1-98.8%).
After 5 years of follow up, OS was 30% with 95% CI 20.8-39.7% and 59.9% with 95% CI
44.5-72.2% for the EST group and the CT group, respectively.
Fig. 1A
Progression free survival according to treatment group
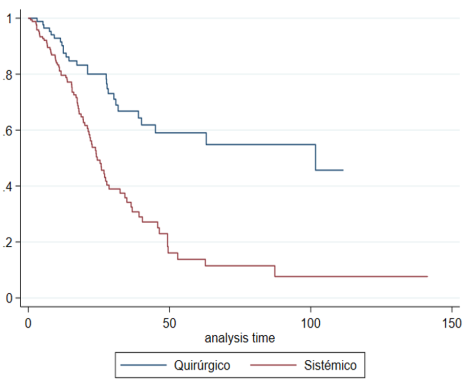
Fig. 1B
overall survival according to treatment group
4.3. Confounding Factor Adjustment
Based on the results of the study and data from the literature, we considered as confounding
variables for adjustment: age, menopausal status, tumor size, site of metastasis,
number of metastases, status of hormone and HER2 receptors, molecular subtype, cytotoxic
and endocrine systemic management.
The PFS shows an unadjusted analysis with HR 0.34 CI 95 % 0.22-0.52 (p<0.001) and
the OS of 0.33 CI 95% 0.21-0.52 (p <0.001) (Table 5).
Table 5
Crude analysis of progression free survival and overall survival
|
Observed estimate
|
|
|
|
|
|
|
|
|
Progression free survival
|
|
|
Overall survival
|
|
|
|
|
HR
|
CI95%
|
P value
|
HR
|
CI95%
|
P value
|
|
Type of treatment
|
|
|
|
|
|
|
|
Systemic
|
Ref.
|
|
|
Ref
|
|
|
|
Surgical + systemic
|
0.34
|
0.22 - 0.52
|
<0.001
|
0.33
|
0.21 - 0.52
|
<0.001
|
The adjusted results can be seen in Table 6, showing that for both PFS and OS there is a statistically significant association
in favor of CT. In the adjusted estimates, PFS showed a significant association with
triple-negative subtype, the presence of liver metastasis and tumor size, T4b being
of higher risk. Although T4a, T4d, and Tx showed significant results, the patient
group for each of these categories was small and the confidence intervals wide. The
same occurred with endocrine management and the use of CDKI and fulvestrant. As for
the clinical staging of the nodules, confidence intervals for these categories were
also wide.
Table 6
Adjusted analysis of Progression free survival and Overall Survival
|
|
Adjusted estimates
|
|
|
|
|
|
|
|
|
|
Progression free survival
|
|
|
|
Overall survival
|
|
|
|
|
|
HR
|
CI95%
|
|
P value
|
HR
|
CI95%
|
|
P value
|
|
Type of treatment
|
|
|
|
|
|
|
|
|
|
Systemic
|
Ref.
|
|
|
|
Ref.
|
|
|
|
|
Surgical + systemic
|
0.28
|
0.16 - 0.5
|
|
<0.001
|
0.23
|
0.13 - 0.43
|
|
<0.001
|
|
Molecular Subtype
|
|
|
|
|
|
|
|
|
|
Her 2
|
Ref.
|
|
|
|
Ref.
|
|
|
|
|
Luminal A
|
1.3
|
0.2
|
9.4
|
0.814
|
6.8
|
1.0
|
48.3
|
0.056
|
|
Luminal B
|
4.5
|
0.7
|
29.3
|
0.116
|
29.7
|
4.7
|
189.0
|
<0.001
|
|
Triple negative
|
3.5
|
1.3
|
9.1
|
0.010
|
13.3
|
4.9
|
36.1
|
<0.001
|
|
Luminal - Her 2
|
2.6
|
0.4
|
16.6
|
0.313
|
3.9
|
0.6
|
23.6
|
0.138
|
|
Liver Metastasis
|
|
|
|
|
|
|
|
|
|
No
|
Ref.
|
|
|
|
Ref.
|
|
|
|
|
Yes
|
2.2
|
1.2
|
4.0
|
0.009
|
1.6
|
0.9
|
2.7
|
0.078
|
|
Number of metastasis
|
|
|
|
|
|
|
|
|
|
1-3 metastasis
|
Ref.
|
|
|
|
Ref.
|
|
|
|
|
> 4 metastasis
|
2.4
|
1.2
|
4.8
|
0.016
|
1.7
|
0.9
|
3.3
|
0.117
|
|
Ct stage
|
|
|
|
|
|
|
|
|
|
T1
|
Ref.
|
|
|
|
Ref.
|
|
|
|
|
T2
|
5.2
|
1.4
|
19.5
|
0.015
|
6.3
|
1.2
|
33.3
|
0.030
|
|
T3
|
4.3
|
0.9
|
19.3
|
0.059
|
8.9
|
1.6
|
50.8
|
0.014
|
|
T4a
|
9.3
|
1.3
|
67.1
|
0.027
|
62.3
|
8.4
|
461.6
|
<0.001
|
|
T4b
|
4.7
|
1.2
|
18.2
|
0.023
|
10.8
|
2.1
|
56.7
|
0.005
|
|
T4c
|
34.2
|
5.6
|
207.9
|
<0.001
|
61.2
|
8.6
|
434.9
|
<0.001
|
|
T4d
|
4.5
|
1.2
|
17.9
|
0.030
|
10.7
|
2.0
|
57.6
|
0.006
|
|
Tx
|
15.1
|
2.1
|
108.4
|
0.007
|
4.2
|
0.3
|
51.4
|
0.263
|
|
Cn stage
|
|
|
|
|
|
|
|
|
|
Nx
|
Ref.
|
|
|
|
Ref.
|
|
|
|
|
N1
|
8.8
|
1.7
|
47.1
|
0.011
|
1.3
|
0.3
|
6.1
|
0.774
|
|
N2
|
14.3
|
2.7
|
76.4
|
0.002
|
2.1
|
0.4
|
10.1
|
0.359
|
|
N3
|
20.1
|
3.5
|
114.0
|
0.001
|
1.8
|
0.3
|
9.1
|
0.487
|
|
N0
|
7.8
|
1.2
|
50.3
|
0.032
|
1.4
|
0.2
|
7.9
|
0.704
|
|
Type of chemotherapy
|
|
|
|
|
|
|
|
|
|
Polychemotherapy
|
Ref.
|
|
|
|
Ref.
|
|
|
|
|
Monochemotherapy
|
1.6
|
1.0
|
2.7
|
0.057
|
1.6
|
1.0
|
2.7
|
0.067
|
|
Did not receive
|
1.1
|
0.6
|
2.3
|
0.700
|
1.8
|
0.9
|
3.4
|
0.077
|
|
Initial endocrine therapy
|
|
|
|
|
|
|
|
|
|
AI+ CDKI
|
Ref.
|
|
|
|
Ref.
|
|
|
|
|
Tamoxifen
|
2.5
|
1.0
|
6.6
|
0.060
|
1.3
|
0.5
|
3.7
|
0.622
|
|
AI
|
2.3
|
1.0
|
5.3
|
0.052
|
1.8
|
0.8
|
4.2
|
0.176
|
|
Fulvestrant
|
3.5
|
1.0
|
11.9
|
0.042
|
2.7
|
0.8
|
9.2
|
0.111
|
|
CDKI +Fulvestrant
|
17.8
|
3.2
|
97.9
|
0.001
|
NE
|
|
|
|
|
Fulvestrant + AI
|
NE
|
|
|
|
NE
|
|
|
|
In the adjusted estimates for OS, significant associations were found in luminal B
subtypes, triple-negative, and tumor staging; however, when reviewing the confidence
intervals, they were all very wide.
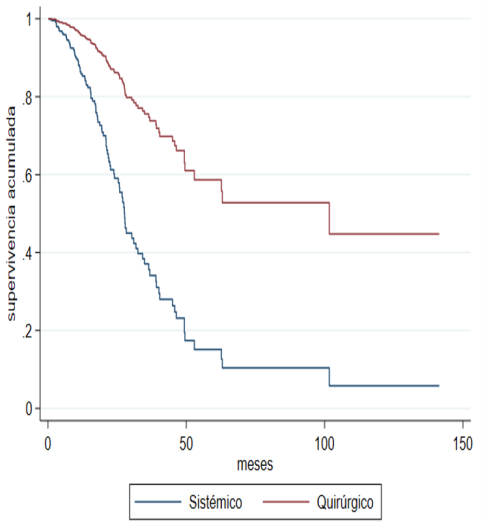
When the sensitivity analysis is carried out by the propensity score considering the
characteristics that differed significantly between the groups by indication of treatment
(pre-T, number of metastases, and site of the metastasis), the adjusted progression-free
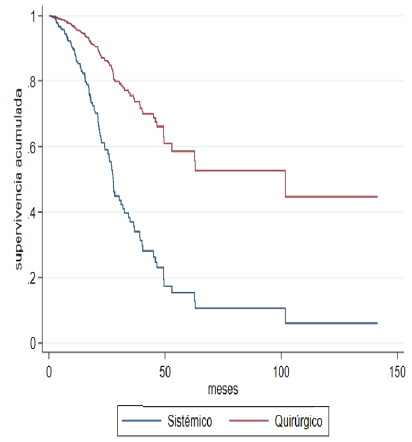
survival curves (Figure 2A) and global (Figure 2B) are drawn, and the significant difference in favor of joint management in terms
of OS and PFS continues to be observed.
Fig. 2A
Adjusted Overall Survival
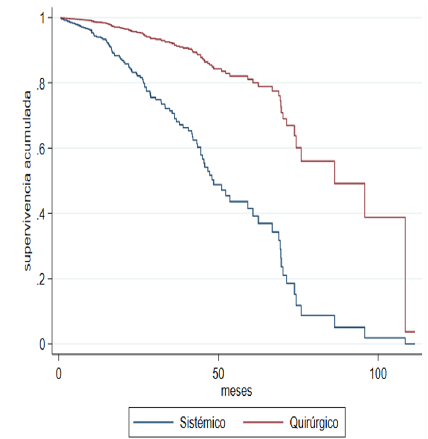
Fig. 2B
Adjusted Progression-Free Survival
5. Discussion
Stage IV breast cancer is a heterogeneous and incurable disease, its management is
aimed at prolonging survival and palliation of symptoms, systemic therapy being the
main pillar. However, multiple studies have been conducted to assess whether CT offers
any additional benefit in oncological outcomes. The present study looked at this group
of patients as well as those treated with EST.
Our study population had an average age of 56 years and a predominance of menopausal
patients, consistent with what is in the literature. Nationally, Diaz and Cols had
an average age of 58.8 years and a 62.9% postmenopausal [14]. And international studies, in general, report an average age of >50 years [1, 6 - 9, 15- 18] and most menopausal patients [5, 7, 12, 17].
The main type of carcinoma in our cohort was the infiltrating subtype, moderate to
high grade, hormone-positive, ductal, which is consistent with the global literature
[6 -9,11,14,17-19]. However, the triple negative subgroup, which has the lowest occurrence in various
studies [6,7,12], took the second place in our cohort. Both in the literature and in our study, tumors
were mainly classified at stage T4 [6, 8, 11, 14,16, 20]. Although, Soran and Cols [6] and Thomas and Colls [18] reported a higher frequency of small T2 stage tumors in their clinical trials.
Most of our patients received EST as in many of the retrospective studies [8, 11,
16-18]; this is supported by research results showing that surgical treatment is not
associated with a higher rate of OS [1, 7, 12, 19]. It is important to note the clinical trial E2108 [7], where they randomized 256 patients to EST and CT, allowed the use of contemporary
systemic therapies and showed the absence of effect on OS; thus, a better locoregional
control in the CT group.
Our research showed that there were better results in OS and PFS in patients with
CT, even after adjusting confounding variables. This is consistent with the findings
of several retrospective descriptive studies and even an RCT [6, 8, 11, 12, 14-19]. The survival benefits of locoregional surgery in stage IV patients are supported
in multiple hypotheses: some studies suggest that index lesion may behave as a reservoir
of sick stem cells and removing it would decrease the likelihood of developing new
sites of distant disease [21]. Resection of the primary tumor can increase angiogenesis by sensitizing it to chemotherapy
and facilitating the entry of the drug into cancer cells [22,23]. Removing necrotic and tumor tissue eliminates chemoresistant tissues, restores host
immunocompetence, and reduces growth of metastases [24, 25] thus resulting in increased patient survival [26]. Although there is the hypothesis
that surgery in this group of patients may stimulate the progression of the disease
by increased release of local growth factors [27], these can accelerate the proliferation of circulating tumor cells in peripheral
blood and affect the OS and PFS [24, 25, 28-30].
In several studies [6, 8, 14, 17] including ours, hormone receptor status was as an independent prognosis factor, suggesting
that tumor biology is important in survival. In contrast, there are also reports where
sub-group tests of the hormone receptor status or HER2 show no benefit in OS [7].
Polymetastatic disease characterized our population as in a previous Colombian study
[14] and in the RCT [1,6,7]. The metastatic pattern, both in number and location of distant disease, has also
been identified as an independent and significant variable for patient survival outcomes
[6,9-12,15,17]. Soran and Cols [6] identified that patients with solitary bone metastasis undergoing surgery had a significant
benefit in OS compared to those who did not undergo surgery, although in their multivariate
analysis, that association proved to be marginal. Rapiti and Cols [10] informed that the surgical effect on survival was not different for patients with
bone metastases vs. other sites; however, after stratification, they observed a positive
effect of surgery with negative margins in those who had bone metastases exclusively.
Moreover, there are also studies where survival did not differ according to the treatment
independent of the metastasis pattern [1, 7, 12]. For instance, Badwe and Cols [1] concluded that surgical management had no impact on patient survival, but also did
not identify any subgroup of patients likely to benefit from locoregional treatment.
Our study found a significant association, with worse PFS, in those patients who had
liver metastases and metastasis number >4, whereas OS showed no association with these
variables.
As in the literature, the most widely used systemic treatment in our population was
chemotherapy [1-9, 12,15-18, 20]. Non-administration of systemic therapy, when indicated, occurs in some retrospective
studies [8, 9, 14, 16, 17], including at the Tata Memorial Hospital in India [1]. In the RCT, treatment with taxans and antiHER2 was limited to only a small number
of patients, thereby affecting their survival results. This is not our case, the patients
received almost entirely the indicated therapies, allowing us to observe the real
impact of local control on the patient’s survival with protocol management.
Due to the retrospective nature of the study, one of its limitations is the lack of
randomization and thus the possible bias of selection for the treatment groups, this
would explain the beneficial effect in OS and PFS in patients receiving CT. Retrospective
studies showed that patients who underwent surgery had better prognostic characteristics
[30-33] and some had responded to systemic treatment, which could then be the causes of better
survival and not the surgical procedure itself [12]. In our study, patients undergoing surgery had a higher tumor load; it was also observed
that when grouping surgical indications, most of them presented a complete or partial
response to systemic therapy, leading us to consider that the benefit would be associated
with systemic treatment. Similarly, the sample size is low, which does not allow us
to establish a clinical recommendation.
As for the clinical records, some patients lacked information about their management,
most evident in the early years. However, those were excluded so that they did not
affect the results.
6. Conclusion
In patients with metastatic breast cancer at debut, the additional benefit that locoregional
surgical management can offer is controversial. The higher quality RCT argues that
locoregional control does not offer a better OS, while retrospective studies, resulting
from real-life experiences, like our research, report a benefit with surgical management.
1. Introducción
Del 3 al 8 % de los pacientes diagnosticados con cáncer de mama pueden debutar con
enfermedad metastásica [1]. El tratamiento estándar para estos casos es la terapia sistémica con la que se han
mejorado significativamente la supervivencia global (SG) y la supervivencia libre
de progresión (SLP), especialmente en aquellas pacientes con receptores hormonales
o Her 2 positivo [2,3].
Actualmente, la cirugía se ha concebido con un enfoque terapéutico complementario,
con el objetivo de paliar los síntomas y prevenir las complicaciones asociadas a la
progresión local de la enfermedad [3]. Sin embargo, se ha sugerido también que tiene un potencial efecto benéfico para
prolongar la SG de los pacientes a través de diversos mecanismos, como la reducción
de la carga tumoral, la eliminación de células madre cancerosas, la reversión de la
inmunosupresión inducida por el tumor, la reducción de la heterogeneidad clonal, la
interrupción de la autosiembra del tumor primario, la interrupción del movimiento
multidireccional de células tumorales entre el tumor primario y sitios distantes y
la reducción de las actividades promotoras de tumores mediadas por las células madre
cancerígenas [4].
Por lo anterior, el uso conjunto del manejo sistémico y quirúrgico en pacientes con
cáncer de mama estadio IV ha sido objeto de investigación. Los ensayos clínicos aleatorizados
(ECA) reportan resultados contradictorios en cuanto a la SG de quienes reciben ambas
terapias [3,5-7], mientras que los estudios retrospectivos, resultantes de experiencias en condiciones
reales, muestran una mejoría en este parámetro [3,8-12], lo que proporciona así evidencia relevante en la toma de decisiones terapéuticas.
Sumada a los estudios anteriores, esta investigación tuvo como objetivo describir
la SG y la SLP de pacientes con cáncer de mama estadio IV inicial, que recibieron
terapia conjunta (TC) y terapia sistémica exclusiva (TSE) en un centro de referencia
oncológico de la ciudad de Medellín, Colombia.
2. Metodología
Se realizó un estudio observacional de cohorte retrospectivo, tomado de la base de
datos de la Fundación Colombiana de Cancerología Clínica Vida de Medellín, entre 2013
y 2021. La recolección de los datos se realizó desde el 1.o de octubre del 2022 hasta el 15 de enero del 2023. Se registraron los datos de las
personas que cumplieron con los criterios de inclusión, por lo que la muestra correspondió
al total de pacientes.
2.1. Pacientes
Los siguientes son los criterios de inclusión para el estudio: 1) pacientes mayores
de 18 años con cáncer de mama infiltrante estadio IV al diagnóstico, 2) confirmación
histológica de la enfermedad primaria, 3) confirmación clínica o paraclínica de la
enfermedad metastásica, 4) manejo con terapia sistémica sola o con cirugía local o
regional, se consideró cualquier tipo de intervención quirúrgica en la mama o axila.
Se revisaron 270 historias de pacientes que cumplían con dichos criterios. Se consideraron
los siguientes criterios de exclusión: historias con más del 10 % de los datos perdidos,
enfermedad estadio IV por progresión, embarazo, lactancia, cáncer de mama metacrónico
y cáncer de mama como segundo primario.
2.2. Variables
La variable resultado principal fue la SG calculada desde el inicio del tratamiento
hasta el último seguimiento o muerte por cualquier causa. La SLP fue una variable
resultado secundario que se calculó desde el inicio del tratamiento hasta la fecha
del último seguimiento o en la que se documentó progresión.
Las variables se evaluaron en dos grupos de pacientes: manejo sistémico exclusivo
y manejo conjunto (tratamiento sistémico más quirúrgico mamario o axilar). En ambos
grupos se recopilaron las características de los individuos al momento del diagnóstico:
edad, estado de la menopausia e índice de masa corporal (IMC). También se registraron
las características del tumor: tipo y grado histológico, subtipo molecular, tamaño
tumoral, clasificación clínica y patológica de los ganglios regionales de acuerdo
con la clasificación TNM [13], sitio y número de metástasis, fecha y sitio de la primera progresión.
La fecha del diagnóstico correspondió a la descrita en el primer estudio de extensión
que documentó la enfermedad a distancia; si esta información no estaba disponible,
se registró la fecha del reporte de biopsia que informó el cáncer, y si no se contaba
con ninguna de las anteriores, se usó la fecha suministrada en la base de datos de
la institución. Para la fecha de progresión de la enfermedad se registró la del primer
estudio que la documentó. Finalmente, la fecha de corte para evaluar la SG fue el
8 de enero del 2023 a través de la plataforma Adres (www.adres.gov.co/consulte-su-ep).
2.3. Métodos estadísticos
Se realizó un análisis univariado para caracterizar a la población de estudio. En
el caso de las variables cuantitativas se aplicó la prueba de normalidad de Kolmogorov-Smirnov,
para definir si se presentaban con promedios o medianas. Las variables cualitativas
se presentaron usando frecuencias absolutas y relativas. La mediana de la supervivencia
se calculó mediante la curva de Kaplan-Meier.
Para el análisis bivariado se calcularon las asociaciones con respecto a la supervivencia
con cada uno de los factores de manera independiente. Para el caso de las variables
cualitativas con ji al cuadrado de independencia y para las cuantitativas se calculó
con la prueba t de student o U de Mann-Whitney (cuantitativa-cualitativa). Las diferencias
en la supervivencia según covariables se calcularon con la prueba de log Rank test.
Se realizó un análisis multivariado para medir la asociación entre covariables y el
tiempo a la presentación del evento mediante una regresión de Cox. Un valor de p inferior
a 0,05 se consideró estadísticamente significativo.
Como análisis de sensibilidad del posible efecto de confusión por indicación se realizó
un análisis por propensity score con un modelo de regresión logística, estimando el efecto esperado en toda la muestra.
La diferencia de probabilidades se presenta con su respectivo intervalo de confianza.
Todos los análisis se realizaron en el programa STATA versión 16.1.
3. Resultados
Un total de 270 pacientes, todas mujeres, cumplieron con los criterios de inclusión.
Se excluyeron ocho casos porque se desconocía la fecha de inicio del tratamiento,
lo que dejó un grupo final de 262 pacientes; 174 recibieron TSE y 88, TC.
La Tabla 1 muestra que los grupos de manejo estaban balanceados por sus características demográficas.
Tabla 1
Características demográficas
|
Características
|
Tratamiento sistémico (N = 174)
|
Tratamiento sistémico + quirúrgico (N = 88)
|
P
|
|
Edad, media ± desviación estándar
|
56,6 (13,4)
|
56,3 (14)
|
0,17
|
|
Estado menopáusico
|
|
|
|
|
Premenopáusicas
|
48 (27,6)
|
26 (29,5)
|
0,77
|
|
Posmenopáusicas
|
122 (70,1)
|
61 (69,3)
|
|
|
Desconocido
|
4 (2,3)
|
1 (1,1)
|
|
|
Índice de masa corporal
|
|
|
|
|
Bajo peso: < 18,5
|
18 (10,3)
|
6 (6,8)
|
0,19
|
|
Normal: 18,5-24,9
|
74 (42,5)
|
27 (30,7)
|
|
|
Sobrepeso: 25-29,9
|
45 (25,9)
|
29 (33)
|
|
|
Obesidad: > 30
|
17 (9,8)
|
14 (15,9)
|
|
|
Desconocido
|
20 (11,5)
|
12 (13,6)
|
|
Las características de la enfermedad se reportan en la Tabla 2. Las pacientes del TC presentaron significativamente más oligometástasis y tumores
inflamatorios, mientras que las pacientes de TSE tenían significativamente más metástasis
óseas, pleurales y hepáticas, además de tumores T4b. Las demás características se
encontraban balanceadas.
Tabla 2
Características de la enfermedad
|
Características
|
Tratamiento sistémico (N = 174)
|
Tratamiento sistémico + quirúrgico (N = 88)
|
P
|
|
Lateralidad
|
|
|
|
|
Unilateral
|
165 (94,8)
|
83 (94,3)
|
0,53
|
|
Bilateral
|
9 (5,2)
|
5 (5,7)
|
|
|
Tipo histológico
|
|
|
|
|
Carcinoma ductal infiltrante
|
144 (82,8)
|
81 (92)
|
0,26
|
|
Carcinoma lobular infiltrante
|
13 (7,5)
|
5 (5,7)
|
|
|
Mixto
|
2 (1,1)
|
0
|
|
|
Otro
|
5 (2,9)
|
0
|
|
|
Cáncer oculto
|
3 (1,7)
|
0
|
|
|
Desconocido
|
7 (4)
|
2 (2,3)
|
|
|
Grado histológico
|
|
|
|
|
1
|
17 (9,8)
|
8 (9,1)
|
0,15
|
|
2
|
73 (42)
|
32 (36,4)
|
|
|
3
|
65 (37,4)
|
35 (39,8)
|
|
|
Oculto
|
6 (3,4)
|
0
|
|
|
Desconocido
|
13 (7,5)
|
13 (14,8)
|
|
|
Estado RE
|
|
|
|
|
Positivo
|
131 (75,3)
|
60 (68,2)
|
0,45
|
|
Negativo
|
42 (24,1)
|
27 (30,7)
|
|
|
Desconocido
|
1 (0,6)
|
1 (1,1)
|
|
|
Estado RP
|
|
|
|
|
Positivo
|
108 (62,1)
|
50 (56,8)
|
0,7
|
|
Negativo
|
64 (36,8)
|
37 (42)
|
|
|
Desconocido
|
2 (1,1)
|
1 (1,1)
|
|
|
Estado Her 2
|
|
|
|
|
Positivo
|
34 (19,5)
|
19 (21,6)
|
0,82
|
|
Negativo
|
138 (79,3)
|
68 (77,3)
|
|
|
Equivoco, no FISH
|
1 (0,6)
|
0
|
|
|
Desconocido
|
1 (0,6)
|
1 (1,1)
|
|
|
Ki 67, mediana + desviación estándar
|
36,4 + 22
|
38,7 + 25,3
|
0,70
|
|
Subtipo IHQ
|
|
|
|
|
Luminal A
|
30 (17,2)
|
15 (17)
|
0,16
|
|
Luminal B
|
85 (48,9)
|
31 (35,2)
|
|
|
Triple negativo
|
25 (14,4)
|
20 (22,7)
|
|
|
Luminal-Her 2
|
18 (10,3)
|
13 (14,8)
|
|
|
Her 2 positivo
|
16 (9,2)
|
8 (9,1)
|
|
|
Desconocido
|
0
|
1 (1,1)
|
|
|
Número de metástasis
|
|
|
|
|
< 4
|
18 (10,3)
|
32 (36,4)
|
< 0,001
|
|
> 4
|
155 (89,1)
|
54 (61,4)
|
|
|
Desconocido
|
1 (0,6)
|
2 (2,3)
|
|
|
Sitio de metástasis
|
|
|
|
|
Ósea
|
123 (70,7)
|
51 (58)
|
0,02
|
|
No
|
51 (29,3)
|
37 (42)
|
|
|
Pulmón
|
59 (33,9)
|
27 (30,7)
|
0,35
|
|
No
|
115 (66,1)
|
61 (69,3)
|
|
|
Hepática
|
39 (22,4)
|
6 (6,8)
|
0,001
|
|
No
|
135 (77,6)
|
82 (93,2)
|
|
|
SNC
|
6 (3,4)
|
2 (2,3 %)
|
0,46
|
|
No
|
168 (96,6)
|
86 (97,7)
|
|
|
Ganglionar a distancia
|
49 (28,2)
|
22 (25)
|
0,34
|
|
No
|
125 (71,8)
|
66 (75)
|
|
|
Pleural
|
19 (10,9)
|
4 (4,5)
|
0,06
|
|
No
|
155 (89,1)
|
84 (95,5)
|
|
|
Otros
|
19 (10,9)
|
3 (13,6)
|
0,02
|
|
No
|
155 (89,1)
|
865 (96,6)
|
|
|
Tamaño del tumor
|
|
|
|
|
T1
|
4 (2,3)
|
2 (2,3)
|
0,02
|
|
T2
|
32 (18,4)
|
14 (15,9)
|
|
|
T3
|
19 (10,9)
|
13 (14,8)
|
|
|
T4a
|
2 (1,1)
|
5 (5,7)
|
|
|
T4b
|
80 (46)
|
34 (38,6)
|
|
|
T4C
|
5 (2,9)
|
3 (3,4)
|
|
|
T4d
|
17 (9,8)
|
17 (19,3)
|
|
|
TX
|
9 (5,2)
|
0
|
|
|
Desconocido
|
6 (3,4)
|
0
|
|
|
Focalidad
|
|
|
|
|
Unifocal
|
157 (90,2)
|
81 (92)
|
0,17
|
|
Multifocal
|
7 (4)
|
3 (3,4)
|
|
|
Multicéntrico
|
3 (1,7)
|
2 (2,3)
|
|
|
Multifocal y multicéntrico
|
0
|
2 (2,3)
|
|
|
Oculto
|
5 (2,9)
|
0
|
|
|
Desconocido
|
2 (1,1)
|
0
|
|
|
N Clínico
|
|
|
|
|
N1
|
58 (33,3)
|
29 (33,3)
|
0,16
|
|
N2
|
58 (33,3)
|
28 (31,8)
|
|
|
N3
|
29 (16,7)
|
24 (27,3)
|
|
|
N0
|
14 (8)
|
6 (6,8)
|
|
|
Nx
|
8 (4,6)
|
0
|
|
|
Desconocido
|
7 (4,1)
|
1 (1,1)
|
|
Al evaluar las características del tratamiento se encontraron diferencias significativas
entre los grupos en casi todas sus variables. Así, las pacientes del TC presentaron
significativamente mayor requerimiento de terapia citotóxica, poliquimioterapia y
uso de antracíclicos con taxanos; mientras que las pacientes con TSE recibieron significativamente
más terapia endocrina con inhibidores de aromatasa (IA) y la combinación de IA con
inhibidores de quinasas dependientes de ciclinas (ICDK). La radioterapia se administró
significativamente en mayor proporción en el grupo de TC. No se presentaron diferencias
entre los grupos en lo referente al uso de terapia anti-Her y supresión de la función
ovárica (Tabla 3).
Las características del manejo quirúrgico se presentan en la Tabla 4.
Tabla 3
Características del tratamiento
|
Características
|
Tratamiento sistémico (N = 174)
|
Tratamiento sistémico + quirúrgico (N = 88)
|
P
|
|
Terapia citotóxica
|
|
|
|
|
Monoquimioterapia
|
61 (35,1)
|
20 (22,7)
|
0,002
|
|
Poliquimioterapia
|
70 (40,2)
|
56 (63,6)
|
|
|
No QT/no acepta
|
43 (24,7)
|
12 (13,6)
|
|
|
Medicamentos para quimioterapia
|
|
|
|
|
Taxanos
|
53 (30,5)
|
13 (14,8)
|
0,001
|
|
Antraciclinas
|
14 (8)
|
2 (2,3)
|
|
|
Platinos
|
0
|
1 (1,1)
|
|
|
Capecitabina
|
1 (0,6)
|
1 (1,1)
|
|
|
Taxanos y platinos
|
10 (5,7)
|
7 (8)
|
|
|
Taxanos y antraciclinas
|
38 (21,8)
|
40 (45,5)
|
|
|
Taxano y otros
|
6 (3,4)
|
3 (3,4)
|
|
|
Antracíclicos y otros
|
2 (1,1)
|
1 (1,1)
|
|
|
Platinos y otros
|
1 (0,6)
|
0
|
|
|
Taxanos, antraciclinas y platinos
|
3 (1,7)
|
3 (3,4)
|
|
|
Otros
|
3 (1,7)
|
6 (6,8)
|
|
|
No requiere
|
43 (24,7)
|
11 (12,5)
|
|
|
Terapia endocrina
|
|
|
|
|
Tamoxifeno
|
16 (9,2)
|
17 (19,3)
|
0,01
|
|
Inhibidor de aromatasa
|
60 (34,5)
|
26 (29,5)
|
|
|
Fulvestrant
|
4 (2,3)
|
5 (5,7)
|
|
|
Inhibidor de ciclinas y aromatasa
|
37 (21,3)
|
6 (6,8)
|
|
|
Inhibidor de ciclinas y fulvestran
|
2 (1,1)
|
0
|
|
|
Fulvestran anastrazol
|
1 (0,6)
|
0
|
|
|
No recibe
|
11 (6,3)
|
4 (4,5)
|
|
|
No requiere
|
43 (24,7)
|
30 (34,1)
|
|
|
Supresión de la función ovárica
|
|
|
|
|
Quirúrgico
|
19 (10,9)
|
7 (8)
|
0,47
|
|
Medicamento
|
6 (3,4)
|
6 (6,8)
|
|
|
Radioterapia
|
3 (1,7)
|
3 (3,4)
|
|
|
No recibe
|
8 (4,6)
|
2 (2,3)
|
|
|
No requiere
|
138 (79,3)
|
70 (79,5)
|
|
|
Terapia Anti Her 2
|
|
|
|
|
Trastuzumab
|
10 (5,7)
|
10 (11,4)
|
0,4
|
|
Pertuzumab
|
2 (1,1)
|
0
|
|
|
Tratuzumab + pertuzumab
|
25 (14,4)
|
12 (13,6)
|
|
|
No recibe
|
1 (0,6)
|
0
|
|
|
No requiere
|
136 (78,2)
|
66 (75)
|
|
|
Radioterapia locorregional
|
|
|
|
|
Mama
|
7 (4)
|
2 (2,3)
|
< 0,001
|
|
Mama y ganglios locorregionales
|
5 (2,9)
|
6 (6,8)
|
|
|
Reja costal
|
0
|
8 (9,1)
|
|
|
Reja costal y ganglios locorregionales
|
0
|
9 (10,2)
|
|
|
Axila
|
1 (0,6)
|
1 (1,1)
|
|
|
No administran
|
156 (89,7)
|
35 (39,8)
|
|
|
Desconocido
|
5 (2,9)
|
27 (30,7)
|
|
|
Radioterapia a la metástasis
|
|
|
|
|
Si
|
70 (40,2)
|
21 (23,9)
|
0,04
|
|
No
|
102 (58,6)
|
67 (76,1)
|
|
|
Desconocido
|
2 (1,2)
|
0
|
|
Tabla 4
Características de manejo quirúrgico
|
Características
|
Tratamiento sistémico + quirúrgico (N = 88)
|
|
Media de N positivos por patología
|
5,3 + 6,2
|
|
Primer manejo
|
|
|
Sistémico
|
78 (88,6)
|
|
Quirúrgico
|
10 (11,4)
|
|
Causa de cirugía
|
|
|
Higiénica
|
24 (27,3)
|
|
Respuesta sistémica pero no local, aunque estable
|
21 (23,9)
|
|
Respuesta clínica completa
|
11 (12,5)
|
|
Sin respuesta sistémica o local
|
1 (1,1)
|
|
Enfermedad sistémica estable y progresión local
|
1 (1,1)
|
|
Otros
|
10 (11,4)
|
|
Desconocido
|
20 (22,7)
|
|
Tipo de cirugía
|
|
|
Mastectomía radical modificada
|
71 (80,7)
|
|
Mastectomía simple
|
2 (2,3)
|
|
Cirugía conservadora y vaciamiento axilar
|
10 (11,4)
|
|
Cirugía conservadora
|
1 (1,1)
|
|
Cirugía conservadora y biopsia de ganglio centinela
|
2 (2,3)
|
|
Vaciamiento axilar
|
2 (2,2)
|
4. Supervivencia
Los 262 pacientes aportaron un total de 6910,92 meses de seguimiento con una media
de 58,38 meses (rango 48,6-68 meses) y una mediana de 36,17 meses (IC 95 % 26,91-45,42).
4.1. Supervivencia libre de progresión
Ocurrieron 114 eventos de progresión, 85 en el grupo de TSE y 29 en el grupo de TC.
La media de SLP en el grupo de TSE fue de 38,56 meses (rango 29,89-47,24); mientras
que para el grupo de TC fue de 72,25 (rango 60,92-83,37); el resultado fue estadísticamente
significativo (p < 0,001) (Figura 1A).
La SLP al año del diagnóstico fue de 79,6 % (IC 95 % 72,2-85,2 %) y 90,2 % (IC 95
% 81,4-95 %); a los cinco años de 11,5 % (IC 95 % 4,6-21,8 %) y 54,6 % (IC 95 % 30,8-67,9
%) para la TSE vs. el TC respectivamente.
4.2. Supervivencia global
Se presentaron 118 muertes, 92 en el grupo de TSE y 26 en el grupo de TC. La mediana
de SG para toda la población fue de 48,63 meses (IC 95 % 40,43-56,82), para el grupo
de TSE fue de 42,4 meses (IC 95 % 33, 23-51,56) y para el grupo de TC fue de 82,33
(IC 95 % 62,1 -102,55), con una diferencia estadísticamente significativa (p < 0,001)
(Figura 1B).
La SG al año del diagnóstico fue de 85,7 % (IC 95 %: 79,4-90,2 %) y 96,4 % (IC 95
%: 89,1-98,8 %); a los cinco años fue de 30 % con IC 95 % 20,8-39,7 % y 59,9 % con
IC 95 % 44,5-72,2 % para el grupo de TSE y para el grupo de TC respectivamente.
Figura 1A
Supervivencia libre de progresión por grupo de tratamiento.
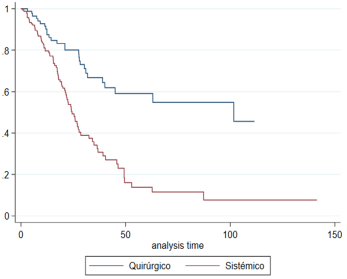
Figura 1B
Supervivencia global discriminada por grupo de tratamiento.
4.3. Ajuste por factores confusores
Con base en los resultados del estudio y lo reportado por la literatura, se consideraron
como variables confusoras para el ajuste la edad, el estado menopaúsico, el tamaño
tumoral, el sitio de metástasis, el número de metástasis, el estado de los receptores
hormonales y de Her 2, el subtipo molecular, el manejo sistémico citotóxico y endocrino.
La SLP muestra un análisis no ajustado con HR 0,34 IC 95 % 0,22-0,52 (p < 0,001) y
la SG de 0,33 IC 95 % 0,21-0,52 (p < 0,001) (Tabla 5).
Tabla 5
Análisis no ajustado de sobrevida libre de progresión y sobrevida global
|
Estimación observada
|
|
|
|
|
|
|
|
|
Sobrevida libre de progresión
|
|
|
Sobrevida global
|
|
|
|
|
HR
|
IC 95 %
|
valor p
|
HR
|
IC 95 %
|
valor p
|
|
Tipo de tratamiento
|
|
|
|
|
|
|
|
Sistémico
|
Ref.
|
|
|
Ref
|
|
|
|
Quirúrgico + sistémico
|
0,34
|
0,22-0,52
|
< 0,001
|
0,33
|
0,21 - 0,52
|
< 0,001
|
Los resultados ajustados pueden observarse en la Tabla 6 y muestran que tanto para SLP como para SG hay una asociación que persiste, siendo
estadísticamente significativa a favor de la TC. En las estimaciones ajustadas, la
SLP mostró una asociación significativa con el subtipo triple negativo, la presencia
de metástasis hepática y el tamaño del tumor, siendo de mayor riesgo la clasificación
T4b. Aunque T4a, T4d y Tx mostraron un resultado significativo, el grupo de pacientes
para cada una de estas categorías era pequeño y los intervalos de confianza amplios.
Lo mismo ocurrió con el manejo endocrino y el uso de ICDK con fulvestran. En cuanto
a la estadificación clínica de los ganglios, si bien N1, N2 y N3 tenían la mayor cantidad
de pacientes, los intervalos de confianza para estas categorías también resultaron
amplios.
Tabla 6
Análisis ajustado de sobrevida libre de progresión y sobrevida global
|
|
Estimaciones ajustadas
|
|
|
|
|
|
|
|
|
|
Sobrevida libre de progresión
|
|
|
|
Sobrevida global
|
|
|
|
|
|
HR
|
IC 95 %
|
|
valor p
|
HR
|
IC 95 %
|
|
valor p
|
|
Tipo de manejo
|
|
|
|
|
|
|
|
|
|
Sistémico
|
Ref.
|
|
|
|
Ref.
|
|
|
|
|
Quirúrgico + sistémico
|
0,28
|
0,16 - 0,5
|
|
< 0,001
|
0,23
|
0,13 - 0,43
|
|
< 0,001
|
|
Subtipo molecular
|
|
|
|
|
|
|
|
|
|
Her 2
|
Ref.
|
|
|
|
Ref.
|
|
|
|
|
Luminal A
|
1,3
|
0,2
|
9,4
|
0,814
|
6,8
|
1,0
|
48,3
|
0,056
|
|
Luminal B
|
4,5
|
0,7
|
29,3
|
0,116
|
29,7
|
4,7
|
189,0
|
< 0,001
|
|
Triple negativo
|
3,5
|
1,3
|
9,1
|
0,010
|
13,3
|
4,9
|
36,1
|
< 0,001
|
|
Luminal - Her 2
|
2,6
|
0,4
|
16,6
|
0,313
|
3,9
|
0,6
|
23,6
|
0,138
|
|
Metástasis hepática
|
|
|
|
|
|
|
|
|
|
No
|
Ref.
|
|
|
|
Ref.
|
|
|
|
|
Sí
|
2,2
|
1,2
|
4,0
|
0,009
|
1,6
|
0,9
|
2,7
|
0,078
|
|
Número de metástasis
|
|
|
|
|
|
|
|
|
|
1-3 metástasis
|
Ref.
|
|
|
|
Ref.
|
|
|
|
|
> 4 metástasis
|
2,4
|
1,2
|
4,8
|
0,016
|
1,7
|
0,9
|
3,3
|
0,117
|
|
Estadio de cT
|
|
|
|
|
|
|
|
|
|
T1
|
Ref.
|
|
|
|
Ref.
|
|
|
|
|
T2
|
5,2
|
1,4
|
19,5
|
0,015
|
6,3
|
1,2
|
33,3
|
0,030
|
|
T3
|
4,3
|
0,9
|
19,3
|
0,059
|
8,9
|
1,6
|
50,8
|
0,014
|
|
T4a
|
9,3
|
1,3
|
67,1
|
0,027
|
62,3
|
8,4
|
461,6
|
< 0,001
|
|
T4b
|
4,7
|
1,2
|
18,2
|
0,023
|
10,8
|
2,1
|
56,7
|
0,005
|
|
T4c
|
34,2
|
5,6
|
207,9
|
< 0,001
|
61,2
|
8,6
|
434,9
|
< 0,001
|
|
T4d
|
4,5
|
1,2
|
17,9
|
0,030
|
10,7
|
2,0
|
57,6
|
0,006
|
|
Tx
|
15,1
|
2,1
|
108,4
|
0,007
|
4,2
|
0,3
|
51,4
|
0,263
|
|
Estadio Cn
|
|
|
|
|
|
|
|
|
|
Nx
|
Ref.
|
|
|
|
Ref.
|
|
|
|
|
N1
|
8,8
|
1,7
|
47,1
|
0,011
|
1,3
|
0,3
|
6,1
|
0,774
|
|
N2
|
14,3
|
2,7
|
76,4
|
0,002
|
2,1
|
0,4
|
10,1
|
0,359
|
|
N3
|
20,1
|
3,5
|
114,0
|
0,001
|
1,8
|
0,3
|
9,1
|
0,487
|
|
N0
|
7,8
|
1,2
|
50,3
|
0,032
|
1,4
|
0,2
|
7,9
|
0,704
|
|
Tipo de quimioterapia
|
|
|
|
|
|
|
|
|
|
Poliquimioterapia
|
Ref.
|
|
|
|
Ref.
|
|
|
|
|
Terapia monoagente
|
1,6
|
1,0
|
2,7
|
0,057
|
1,6
|
1,0
|
2,7
|
0,067
|
|
No recibe
|
1,1
|
0,6
|
2,3
|
0,700
|
1,8
|
0,9
|
3,4
|
0,077
|
|
Terapia endocrina inicial
|
|
|
|
|
|
|
|
|
|
IA+ ICK
|
Ref.
|
|
|
|
Ref.
|
|
|
|
|
Tamoxifeno
|
2,5
|
1,0
|
6,6
|
0,060
|
1,3
|
0,5
|
3,7
|
0,622
|
|
IA
|
2,3
|
1,0
|
5,3
|
0,052
|
1,8
|
0,8
|
4,2
|
0,176
|
|
Fulvestran
|
3,5
|
1,0
|
11,9
|
0,042
|
2,7
|
0,8
|
9,2
|
0,111
|
|
ICK +fulvestrant
|
17,8
|
3,2
|
97,9
|
0,001
|
NE
|
|
|
|
|
Fulvestrant + IA
|
NE
|
|
|
|
NE
|
|
|
|
En las estimaciones ajustadas para SG se encontraron asociaciones significativas en
los subtipos luminal B, triple negativo y en la estadificación del tumor. Sin embargo,
al revisar los intervalos de confianza todos eran muy amplios.
Cuando se realiza el análisis de sensibilidad por el propensity score, por las características que difirieron significativamente entre los grupos para
la indicación del tratamiento (T previo, número de metástasis y sitio de la metástasis),
se trazan las curvas de supervivencia libre de progresión (Figura 2A) y global (Figura 2B) ajustadas, en las que se continúa observando la diferencia significativa a favor
del manejo conjunto en cuanto SG y SLP.
Figura 2A
Supervivencia global ajustada
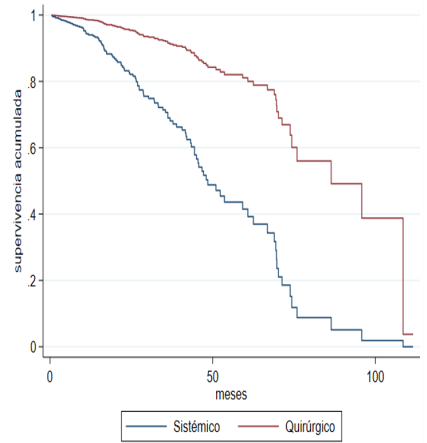
Figura 2B
Supervivencia libre de progresión ajustada
5. Discusión
El cáncer de mama estadio IV es una enfermedad heterogénea e incurable, su manejo
tiene como objetivo la prolongación de la supervivencia y la paliación de los síntomas;
la terapia sistémica es su pilar terapéutico. Sin embargo, se han realizado múltiples
estudios para evaluar si la TC ofrece algún beneficio adicional en los resultados
oncológicos. El presente estudio analizó a tal grupo de pacientes, así como a los
tratados con TSE.
Con una mediana de edad de 56 años y un predominio de pacientes menopaúsicas, este
estudio concuerda con lo reportado en la literatura. A nivel nacional, Díaz et al.
[14] informaron una mediana de edad de 58,8 años y un 62,9 % de posmenopáusicas. Por su
parte, estudios internacionales, en general, reportan una mediana de edad > 50 años
[1,6-9,15-18] y una mayoría de pacientes menopaúsicas [5,7,12,17].
El principal tipo de carcinoma en la cohorte de este estudio fue el ductal infiltrante,
de moderado y alto grado, hormonal positivo, lo que es consistente con la literatura
mundial [6-9,11,14,17-19]. Sin embargo, el subgrupo triple negativo, que es de menor presentación en los diversos
estudios [6,7,12], ocupó el segundo lugar. Tanto en la literatura como en este estudio, los tumores
se clasificaron principalmente en estadio T4 [6,8,11,14,16,20]. Aunque Soran et al. [6] y Thomas et al. [18] informaron en sus ensayos clínicos una mayor frecuencia de tumores pequeños estadio
T2.
La mayoría de las pacientes en este estudio recibieron TSE al igual que lo informado
en gran parte de los estudios retrospectivos [8,11,16-18]; esta indicación se apoya en los resultados de las investigaciones que muestran que
el tratamiento quirúrgico no se asocia a una mayor tasa de SG [1,7,12,19]. Cabe destacar el ensayo clínico E2108 [7] en el que aleatorizaron 256 pacientes a TSE y TC, permitieron el uso de las terapias
sistémicas contemporáneas y evidenciaron la ausencia de efecto en la SG, aunque sí
un mejor control locorregional en el grupo de TC.
Contrario a lo expuesto, esta investigación mostró que sí había mejores resultados
en SG y SLP en las pacientes con TC, incluso después de ajustar por variables confusoras,
lo que es consistente con los hallazgos de varios estudios descriptivos retrospectivos
e incluso un ECA [6,8,11,12,14-19]. Los beneficios en supervivencia de la cirugía locorregional en la paciente en estadio
IV se sustentan en múltiples hipótesis: algunos estudios sugieren que la lesión índice
puede comportarse como reservorio de las células madre enfermas y eliminarlo disminuiría
la probabilidad de desarrollar nuevos sitios de enfermedad a distancia [21]. La resección del tumor primario puede aumentar la angiogénesis sensibilizándolo
a la quimioterapia y facilitando el ingreso del fármaco a las células cancerígenas[22,23]. Extirpar el tejido necrótico y tumoral elimina los tejidos quimioresistentes, restaura
la inmunocompetencia del huésped y reduce el crecimiento de las metástasis [24,25], y resulta en un aumento en la supervivencia de los pacientes [26]. Aunque, por otro lado, existe la hipótesis de que la cirugía en este grupo de pacientes
puede estimular la progresión de la enfermedad por la mayor liberación de factores
de crecimiento locales [27], estos factores de crecimiento a su vez pueden acelerar la proliferación de las células
tumorales circulantes en sangre periférica y afectar la SG y la SLP [24,25,28-30].
En varios estudios [6,8,14,17], incluido este, el estado de los receptores hormonales se informó como un factor
pronóstico independiente, lo que sugiere que la biología del tumor resulta importante
en la supervivencia. En contraste, también hay reportes en los que los análisis por
subgrupo del estado del receptor hormonal o Her 2 no muestran beneficio en SG [7].
La enfermedad polimetastásica caracterizó a la población de este estudio al igual
que en otro estudio colombiano [14] y en los ECA [1,6,7]. El patrón metastásico, tanto en número como en localización de la enfermedad a distancia,
también ha sido identificado como una variable independiente y significativa para
los resultados de supervivencia de los pacientes [6,9-12,15,17]. Soran et al. [6] identificaron que las pacientes con metástasis ósea solitaria, llevadas a cirugía,
tuvieron un beneficio significativo en SG en comparación con quienes no se sometieron
al procedimiento quirúrgico, aunque en su análisis multivariado esa asociación resultó
ser marginal. Rapiti et al. [10] informaron que el efecto de la cirugía en la supervivencia no fue diferente para
las pacientes con metástasis ósea respecto a otros sitios, pero, después de estratificarlas,
observaron un efecto positivo de la cirugía con márgenes negativos en quienes tenían
metástasis óseas exclusivamente. Por otro lado, también hay estudios en los que la
supervivencia no difirió según el brazo de tratamiento, independiente del patrón de
metástasis [1,7,12]. Por ejemplo, Badwe et al. [1] concluyeron que el manejo quirúrgico no impactó en la supervivencia de los pacientes,
pero además no identificaron ningún subgrupo de pacientes susceptibles de beneficiarse
del tratamiento locorregional. En este estudio se encontró una asociación significativa,
con una peor SLP, en aquellas pacientes que presentaban metástasis hepáticas y número
de metástasis > 4, mientras que la SG no mostró asociación con estas variables.
Al igual que lo reportado en la literatura, el tratamiento sistémico más utilizado
en la población de este estudio fue la quimioterapia [1-9,12,15-18, 20]. La no administración de terapia sistémica, cuando estaba indicada, en una importante
cantidad de pacientes de la muestra ocurre en algunos estudios retrospectivos [8,9,14,16,17], incluso en el ECA del Tata Memorial Hospital en la India [1]. En el ECA mencionado, el manejo con taxanos y anti-Her 2 se limitó a solo un pequeño
número de pacientes, lo que afectó sus resultados en supervivencia. Esta situación
no se presenta en este caso, pues las pacientes recibieron casi en su totalidad las
terapias indicadas y esto permitió observar el impacto real del control local en la
supervivencia de las pacientes con el manejo de protocolo.
Debido al carácter retrospectivo del estudio, una de sus limitaciones es la falta
de aleatorización y, por ende, el posible sesgo de selección para los grupos de tratamiento.
Esto explicaría el efecto benéfico reportado en SG y SLP en las pacientes que recibieron
TC. Estudios retrospectivos mostraron que las pacientes operadas tenían mejores características
pronósticas [30-33] y algunas habían presentado respuesta al tratamiento sistémico, estas pudieron ser
entonces las causas de la mejor sobrevida y no el procedimiento quirúrgico [12]. Si bien en este estudio las pacientes llevadas a cirugía tenían una mayor carga
tumoral, también se observó que al agrupar las indicaciones quirúrgicas la mayoría
había presentado una respuesta completa o parcial a la terapia sistémica, lo que llevó
a plantear la posibilidad de que el beneficio se asociara realmente a esta terapia.
En cuanto a los registros en las historias clínicas, algunas pacientes carecían de
información sobre su manejo, más evidente en los primeros años. Sin embargo, aquellas
con información limitada fueron excluidas, por lo que no se afectaron los resultados
reportados.
6. Conclusiones
En pacientes con carcinoma de mama metastásico al debut, el beneficio adicional que
puede ofrecer el manejo quirúrgico locorregional es controversial. El ECA de mayor
calidad sostiene que el control locorregional no ofrece una mejor SG, mientras que
los estudios retrospectivos, resultantes de experiencias en condiciones reales y entre
los cuales se encuentra esta investigación, informan un beneficio con el manejo quirúrgico.